题目内容
13.二氧化硫、一氧化碳、氮的氧化物、氨气都是非常重要的非金属化合物,研究这些化合物对环境保护、理解化学反应原理都具有重要意义.(1)二氧化氮与与水反应的离子方程式为3NO2+H2O=2H++2NO3-+NO.若该反应有a×NA个电子转移,则参加反应的二氧化氮的物质的量为1.5a mol.
(2)下列除去大气污染物的化学方程式不正确的是C.
A.氢氧化钠溶液除去尾气中氮氧化物:NO+NO2+2NaOH=2NaNO2+H2O
B.石灰乳吸收硫酸厂尾气:SO2+Ca(OH)2═CaSO3+H2O
C.汽车尾气经催化剂作用:CO+NO$\frac{\underline{\;\;△\;\;}}{\;}$NO2+C
D.氨气与一氧化氮在一定条件下反应:4NH3+6NO$\frac{\underline{\;催化剂\;}}{△}$5N2+6H2O
(3)在100mL稀硫酸和稀硝酸的混合溶液中,加入一定量的铜粉,微热,使其充分反应,铜粉完全溶解,若测得反应后生成标准状况下NO 1.344L,且最终溶液中只得到一种盐.
①从反应后溶液中获得晶体的实验步骤为蒸发浓缩、冷却结晶或降温结晶、过滤、洗涤、干燥.
②该混合酸中,硝酸的物质的量浓度c(HNO3)应为0.6mol/L
③该混合酸中,硝酸与硫酸的物质的量之比为2:3.
分析 (1)二氧化氮和水反应产物是硝酸和一氧化氮,据此书写离子方程式,根据化合价升降和电子转移进行相关计算;
(2)A.尾气中氮氧化物可以和氢氧化钠溶液反应转化为无毒的亚硝酸钠;
B.石灰乳Ca(OH)2和酸性气体二氧化硫之间可以发生反应生成亚硫酸钙和水;
C.汽车尾气中的有毒气体经催化剂作用可以转化为无毒物质二氧化碳和氮气;
D.氨气与一氧化氮在一定条件下反应,产物是氮气和水.
(3)①从硫酸铜溶液获得硫酸铜晶体的方法:蒸发浓缩、冷却结晶、过滤、洗涤、干燥,据此回答;
②根据硝酸和金属铜反应的实质结合产生气体的量计算硝酸的物质的量,据公式c=$\frac{n}{V}$计算浓度;
③根据反应3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,据硝酸根的物质的量计算总共氢离子物质的量,进而计算硫酸的物质的量,得到结果即可.
解答 解:(1)二氧化氮和水反应产物是硝酸和一氧化氮,离子方程式为:3NO2+H2O=2H++2NO3-+NO,反应有2NA个电子转移,则参加反应的二氧化氮的物质的量为3mol,所以该反应有a×NA个电子转移,则参加反应的二氧化氮的物质的量为1.5a mol,故答案为:3NO2+H2O=2H++2NO3-+NO;1.5a;
(2)A.尾气中氮氧化物可以和氢氧化钠溶液反应,方程式为:NO+NO2+2NaOH=2NaNO2+H2O,故A正确;
B.石灰乳Ca(OH)2和酸性气体二氧化硫之间可以发生反应生成亚硫酸钙和水,即SO2+Ca(OH)2═CaSO3+H2O,故B正确;
C.汽车尾气中的有毒气体CO、NO经催化剂作用可以转化为无毒物质二氧化碳和氮气,不会产生NO2、C,故C错误;
D.氨气与一氧化氮在一定条件下反应,产物是氮气和水,即4NH3+6NO$\frac{\underline{\;催化剂\;}}{△}$5N2+6H2O,故D正确.
故选C.
(3)①从硫酸铜溶液获得硫酸铜晶体的方法:蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故答案为:冷却结晶或降温结晶;
②反应后生成标准状况下NO1.344L,物质的量是$\frac{1.344L}{22.4L/mol}$=0.06mol,所以做氧化剂的硝酸的物质的量是0.06mol,根据反应实质,NO3-~NO↑这些硝酸根离子来自硝酸,所以硝酸的物质的量是0.06mol,该混合酸中,硝酸的物质的量浓度c(HNO3)应为$\frac{0.06mol}{0.1L}$=0.6mol/L,故答案为:0.6mol/L;
③根据反应3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,该混合酸中,硝酸根的物质的量是0.06mol,所以氢离子物质的量是0.24mol,其中0.06mol来自硝酸,剩余的0.18mol来自硫酸,所以硫酸的物质的量是0.09mol,即硝酸与硫酸的物质的量之比为0.06:0.09=2:3,故答案为:2:3.
点评 本题涉及氧化还原反应中电子守恒的计算以及金属铜和硝酸反应的计算知识,属于综合知识的考查题,难度中等.

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案| W | X | Y | Z | |
| 结构或 性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应 呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小,它的最高价氧化物为两性氧化物 | 最高正价与最低负价之和为零 |
(2)X的最高价氧化物的电子式为
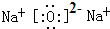 ,它对应的水化物与Y的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
,它对应的水化物与Y的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.(3)W的最高价氧化物对应的水化物属于共价化合物,(填“离子”或“共价”),W和Z形成的气态氢化物的稳定性大小关系是:NH3>SiH4.(用化学式表示)
W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似(醋酸为一元弱酸),体积和浓度均相等的HW3与X的最高价氧化物对应的水化物的溶液混合,反应的化学方程式是HN3+NaOH=NaN3+H2O(方程式中各物质用化学式表示)
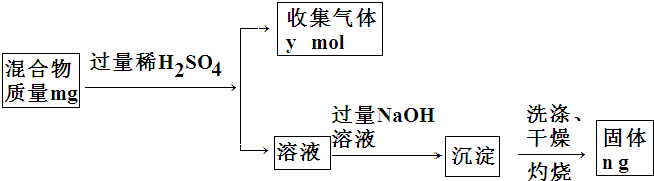
(4)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数.能确定混合物中Y的质量分数的数据有abc(填序号).
a.m、n b.m、y c.n、y
| A. | 乙醇中含有水(生石灰,蒸馏) | |
| B. | 甲烷中含有乙烯(溴水,洗气) | |
| C. | 溴苯中溶有溴(苯,分液) | |
| D. | 乙烷中含有乙烯(酸性高锰酸钾溶液,洗气) |
| A. | 将铜片置于盐酸中 | B. | 将锌片置于MgCl2溶液中 | ||
| C. | 将铁片置于CuSO4溶液中 | D. | Na2CO3 溶液与CaCl2溶液混合 |
| A. | 增大压强,反应速率减小 | |
| B. | 最终可生成0.2 mol NH3 | |
| C. | 升髙温度,反应速率增大 | |
| D. | 当V正(N2):V 正(H2)=1:3时,一定达化学平衡状态 |
| A. | 不同的化学反应,限度可能不同 | |
| B. | 可以通过改变温度来控制化学反应的限度 | |
| C. | 可以通过延长化学反应的时间来改变化学反应的限度 | |
| D. | 一个化学反应在一定条件下达到限度时,正、逆反应速率相等 |
| A. | 油脂是产生能量最高的营养物质 | |
| B. | 苯能发生氧化反应 | |
| C. | 纤维素可在人体内最终水解成葡萄糖 | |
| D. | 谷氨酸分子中含有2种官能团 |
