题目内容
15.氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2+6C+2N2$\frac{\underline{\;高温\;}}{\;}$1Si3N4+6CO
(1)配平上述反应的化学方程式(将化学计量数填在横线内);
(2)该反应的氧化剂是N2,其还原产物是Si3N4;
(3)若已知CO生成速率为v(CO)=18mol•L-1•min-1,则N2消耗速速率为v(N2)=6mol•L-1•min-1.
分析 (1)反应中碳元素由0价升高到+2价,氮元素由0价降低为-3价,已经得失电子数守恒结合原子个数守恒写出方程式;
(2)氧化还原反应中所含元素化合价降低的为氧化剂,对应产物还原产物;
(3)反应速率之比等于方程式计量系数之比,据此计算解答.
解答 解:(1)反应中碳元素由0价升高到+2价,氮元素由0价降低为-3价,依据氧化还原反应得失电子守恒,碳系数为6,氮气系数为2,依据原子个数守恒,方程式:3SiO2+6C+2 N2$\frac{\underline{\;高温\;}}{\;}$ 1 Si3N4+6CO;
故答案为:3,6,2,1,6;
(2)依据方程式可知,氮原子在反应中化合价降低,所以氮气为氧化剂,对应氮化硅为还原产物;
故答案为:N2;Si3N4;
(3)反应速率之比等于方程式计量系数之比,所以v(N2):V(CO)=1:3,v(CO)=18mol•L-1•min-1,则Vv(N2)=6 mol•L-1•min-1;
点评 本题考查了氧化还原方程式配平及反应速率计算,明确氧化还原反应中得失电子守恒是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列正确的是( )
| A. | 向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+=Fe2++2H2O | |
| B. | SO2、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| C. | pH=1的溶液中能大量共存的离子组:Fe2+、NO3-、SO42-、Na+ | |
| D. | NO可用于某些疾病的治疗 |
6.指出下列化合物中化学键的类型、物质分类(离子化合物、共价化合物)以及溶于水时破坏的化学键的类型.
| 化合物 | 化学键的类型 | 物质分类 | 溶于水时破坏的化学键的类型 |
| Na2S | |||
| HCl | |||
| (NH4)2SO4 |
10.下列说法正确的是( )
| A. | 决定反应速率的因素只有催化剂 | |
| B. | 食物放在冰箱中会减慢食物变质的速率 | |
| C. | 锌与稀硫酸反应时,加入少量水能加快产生氢气的速率 | |
| D. | 在一定条件下2mol SO2与 1mol O2混合一定能生成2mol SO3 |
7.羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸反应制得. 下列有关说法正确的是( )
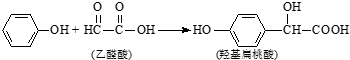
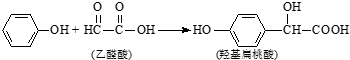
| A. | 苯酚和羟基扁桃酸互为同系物 | |
| B. | 常温下,1mol羟基扁桃酸只能与1mol Br2反应 | |
| C. | 乙醛酸的核磁共振氢谱中只有1个吸收峰 | |
| D. | 羟基扁桃酸可以发生取代、氧化、加成等反应 |
5.下列化合物的同分异构体数目与C3H8O的同分异构体数目相同的是( )
| A. | C3H6 | B. | C4H8 | C. | C6H4Cl2 | D. | C5H12 |
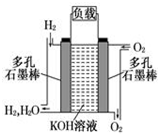 如图为氢氧燃料碱性电池,电极材料为疏松多孔石墨棒.根据所学知识试回
如图为氢氧燃料碱性电池,电极材料为疏松多孔石墨棒.根据所学知识试回 ,A和E元素形成的化合物所含有的化学键是离子键.
,A和E元素形成的化合物所含有的化学键是离子键.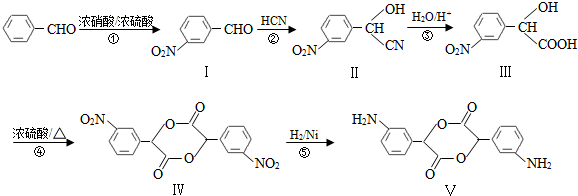
 ,和
,和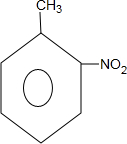 .
.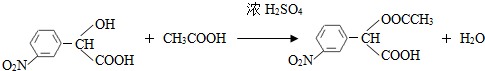 (要求写出反应条件),
(要求写出反应条件),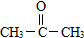 )代替化合物 I发生反应②可以得到化合物Ⅵ,化合物Ⅵ的结构简式为
)代替化合物 I发生反应②可以得到化合物Ⅵ,化合物Ⅵ的结构简式为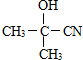 .
.