题目内容
10. 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.为证明浓硫酸在实
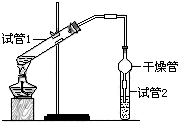
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.为证明浓硫酸在实验室制备乙酸乙酯反应中起催化剂和吸水剂的作用,某同学利用如图所示装置进行了以下四个实验,实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡试管2,再测有机层的厚度,实验记录如下:
| 实验 编号 | 试管1中的试剂 | 试管2中试剂 | 测得有机层的厚度/cm |
| A | 2mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 饱和碳酸钠溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
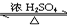 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.(2)干燥管在上述实验中的作用冷凝,防倒吸.
(3)实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是6mL和6mol/L.
(4)分析实验AC(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率.浓硫酸的吸水性能够提高乙酸乙酯产率的原因是浓硫酸可以吸收产物中的水,使平衡向生成乙酸乙酯方向移动.
分析 (1)根据酯化反应原理可知,羧酸脱去羟基醇脱氢;
(2)试管Ⅱ中的试剂用于吸收乙酸乙酯,通常使用饱和碳酸钠溶液;球形干燥管容积较大,利于乙酸乙酯充分与空气进行热交换,起到冷凝的作用,也可起到防止倒吸的作用;
(3)对比试验关键是要采用控制变量,即控制一个变量,其它条件不变,所以可以从控制变量的角度来分析解答;
(4)根据实验A和实验C的数据进行解答;水在酯化反应中为生成物,从生成物对化学平衡的影响角度分析.
解答 解:(1)由于酯化反应中,羧酸脱去的是羟基,故 乙酸乙酯中的氧原子含有18O,反应方程式为CH3COOH+C2H518OH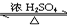 CH3CO18OC2H5+H2O;
CH3CO18OC2H5+H2O;
故答案为:CH3COOH+C2H518OH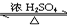 CH3CO18OC2H5+H2O;
CH3CO18OC2H5+H2O;
(2)球形干燥管容积较大,使乙酸乙酯充分与空气进行热交换,起到冷凝的作用,也可起到防止倒吸的作用,
故答案为:冷凝,防倒吸;
(3)本题是研究实验D与实验C相对照,证明H+对酯化反应具有催化作用的条件,题中采用了一个变量,实验C3mol•L-1 H2SO4,实验D盐酸,所以达到实验目的,实验D与实验C中H+的浓度一样,实验C3mL乙醇、2mL乙酸、3mol•L-1 H2SO4,实验D3mL乙醇、2mL乙酸、盐酸,要保证溶液体积一致,才能保证乙醇、乙酸的浓度不变,盐酸体积为6mL,实验D与实验C中H+的浓度一样,所以盐酸的浓度为6mol•L-1,
故答案为:6;6;
(4)对照实验A和C可知:试管Ⅰ中试剂实验A加的是浓硫酸,浓硫酸具有吸水性,实验B加入的是稀硫酸,硫酸的物质的量相同,试管Ⅱ中试剂中测得有机层乙酸乙酯的厚度,实验A为5.0cm,而实验C只有1.2cm,说明浓硫酸的吸水性提高了乙酸乙酯的产率;酯化反应为可逆反应,浓硫酸吸收酯化反应生成的水,降低了生成物浓度,使平衡向生成乙酸乙酯方向移动,
故答案为:AC;浓硫酸可以吸收产物中的水,使平衡向生成乙酸乙酯方向移动.
点评 本题考查了乙酸乙酯的制备方法、温度对反应速率、化学平衡的影响等知识,题目难度中等,注意把握乙酸乙酯的制备原理和实验方法,明确影响反应速率、化学平衡的因素.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 蚕丝、羊毛、病毒等主要成分都是蛋白质 | |
| B. | 蛋白质溶液中加入饱和(NH4)2SO4溶液,蛋白质析出,再加水,也不溶解 | |
| C. | 重金属盐能使蛋白质凝结 | |
| D. | 浓硝酸使皮肤呈黄色是由于浓硝酸与蛋白质发生了颜色反应 |
| A. | 任何晶体中都存在化学键 | |
| B. | 晶体内部的微粒在空间的排列均服从紧密堆积原理 | |
| C. | 任何晶体中,若有阴离子必定含有阳离子 | |
| D. | 金属晶体的熔点都比分子晶体的熔点高 |
| A. | C3H6 | B. | C4H8 | C. | C6H4Cl2 | D. | C5H12 |
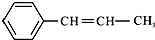 ,它可能具有的性质是( )
,它可能具有的性质是( )| A. | 不溶于水,易溶于有机溶剂 | |
| B. | 既能使溴水褪色,又能使酸性KMnO4溶液褪色 | |
| C. | 能发生聚合反应,其产物可表示为: | |
| D. | 能使溴水褪色,但不能使酸性KMnO4溶液褪色 |
 ,A和E元素形成的化合物所含有的化学键是离子键.
,A和E元素形成的化合物所含有的化学键是离子键.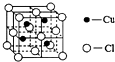 铜是过渡金属元素,可以形成多种化合物.
铜是过渡金属元素,可以形成多种化合物.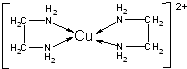
 锂亚硫酰氯(Li-SOCl2)电池具有能量密度高、工作电压和放电电压平稳、工作温度范围宽及贮存寿命长等优点,在航海、医疗及井下油田设备等方面的应用广泛.
锂亚硫酰氯(Li-SOCl2)电池具有能量密度高、工作电压和放电电压平稳、工作温度范围宽及贮存寿命长等优点,在航海、医疗及井下油田设备等方面的应用广泛.