题目内容
【题目】(1)某化学兴趣小组利用下列试剂:铁粉、锌粉、0.1 mol·L1 FeCl3溶液、0.1 mol·L1 FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题。
①用所给试剂写出体现Fe2+具有还原性的反应的化学方程式:_________________________________。
②设计实验方案,完成下列表格。
探究内容 | 实验方案 | 实验现象 |
探究Fe3+具有氧化性 | 取少量0.1 mol·L1 FeCl3溶液,往溶液中加入足量铁粉,再加入少量KSCN溶液 | 加入铁粉后,溶液颜色变为________。加入KSCN溶液后,溶液________ |
③该兴趣小组为说明“Fe2+具有氧化性”,提出了向FeCl2溶液中加入锌粉,观察实验现象的方案,该反应的离子方程式为_________________________________________。
(2)某反应中反应物与生成物有Fe3+、Mn2+、H+、![]() 、H2O和一种未知离子X,已知
、H2O和一种未知离子X,已知![]() 在反应中得到电子,则X离子是____________,该反应的离子方程式是____________________________。
在反应中得到电子,则X离子是____________,该反应的离子方程式是____________________________。
(3)有一铁的氧化物样品,用5 mol·L1的盐酸140 mL恰好完全溶解,所得溶液还能与通入的0.56 L氯气(标准状况)反应,使Fe2+全部转化为Fe3+,则此氧化物为________。
【答案】 2FeCl2+Cl2===2FeCl3 浅绿色 不变色 Fe2++Zn===Zn2++Fe Fe2+ ![]() +5Fe2++8H+===Mn2++5Fe3++4H2O Fe5O7
+5Fe2++8H+===Mn2++5Fe3++4H2O Fe5O7
【解析】
(1)①根据分析可以知道:加入氧化剂氯水会氧化亚铁离子为铁离子,化学反应方程式为:2FeCl2+Cl2=2FeCl3;因此,本题正确答案是:2FeCl2+Cl2=2FeCl3;②探究铁离子具有氧化性,根据图表中实验步骤,取少量0.1mol/L FeCl3溶液,往溶液中加入足量铁粉,再加入少量KSCN溶液,加入铁粉后,发生反应Fe+2FeCl3=3FeCl2,溶液颜色变为浅绿色,加入硫氰酸钾溶液不变红色,证明无铁离子;③锌和亚铁离子反应发生置换反应生成铁和锌离子,反应的离子方程式为:Fe2++Zn═Zn2++Fe;
(2)已知MnO4-在反应中得到电子,根据氧化还原反应电子守恒,元素化合价有升高和降低,所以判断X为亚铁离子失电子发生氧化反应;高锰酸根离子具有氧化性在酸溶液这氧化亚铁离子为铁离子,本身被还原为锰离子,反应的离子方程式为:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O;
(3)![]() ,
,![]() ,所以
,所以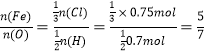 ,即该氧化物的化学式为Fe5O7。
,即该氧化物的化学式为Fe5O7。

【题目】研究铝元素、硫元素及其化合物的性质具有重要意义
(1)①NH4A1(SO4)2可作净水剂,用必要的化学用语及文字说明其理由是_________。
②相同条件下,0.1mol NH4A1(SO4)2溶液中的c(NH4+)______(填“大于”“小于”或“等于”)0.1mol·L-1NH4HSO4溶液中的c(NH4+)。
(2)25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。

①pH=13时,溶液中的c(H2S)+c(HS-)=_____mol·L-1.
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH=______时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如右表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-4 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的电离平衡常数表达式K=______。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为_____。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为______。