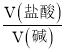��Ŀ����
����Ŀ���о���Ԫ�ء���Ԫ�ؼ��仯��������ʾ�����Ҫ����
��1����NH4A1(SO4)2������ˮ�����ñ�Ҫ�Ļ�ѧ���P����˵����������_________��
����ͬ�����£�0.1mol NH4A1(SO4)2��Һ�е�c(NH4+��______������ڡ���С�ڡ����ڡ���0.1mol��L-1NH4HSO4��Һ�е�c��NH4+����
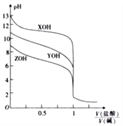
��2��25�棬��0.10mol��L-1H2S��Һ�У�ͨ��HCl��������NaOH�����Ե�����ҺpH����ҺpH��c(S2-)��ϵ��ͼ��������Һ����ı仯��H2S�Ļӷ�����

��pH=13ʱ����Һ�е�c(H2S)+c(HS-)=_____mol��L-1.
��ij��Һ��0.020 mol��L-1Mn2+��0.10 mol��L-1H2S������ҺpH=______ʱ��Mn2+��ʼ������[��֪��Ksp(MnS)=2.8��10-13]
��3��25�棬������ĵ���ƽ�ⳣ�����ұ���
Ka1 | Ka2 | |
H2SO3 | 1.3��10-2 | 6.3��10-4 |
H2CO3 | 4.2��10-7 | 5.6��10-11 |
��HSO3-�ĵ���ƽ�ⳣ������ʽK=______��
��0.10 mol��L-1Na2SO3��Һ������Ũ���ɴ�С��˳��Ϊ_____��
��H2SO3��Һ��NaHCO3��Һ��Ӧ����Ҫ���ӷ���ʽΪ______��
���𰸡� A13++3H20Al(OH)3(����)+3H+,������������� С�� 0.043 5 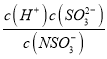 (Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+) c(OH-)+c(CO32-)=c(H+)+c(H2CO3)
(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+) c(OH-)+c(CO32-)=c(H+)+c(H2CO3)
����������1����NH4Al(SO4)2������ˮ����������Al3+��ˮ��Һ�з���ˮ������Al(OH)3���壬��Al3++3H2OAl(OH)3(����)+3H+��Al(OH)3������������ԣ�����������ʹ������Ӷ�����ˮ������ͬ�����£�NH4Al(SO4)2��Һ�е�Al3+ˮ���������������NH4+ˮ�⣬ NH4HSO4��ˮ��Һ����ȫ����������ӣ�����NH4+��ˮ�⣬���Ƴ̶ȱ�ǰ�ߴ�����0.1mol NH4Al(SO4)2��Һ�е�c(NH4+��С��0.1mol��L-1NH4HSO4��Һ�е�c(NH4+)��
��2������ͼ��֪����pH=13ʱ��c(S2-)=5.7![]() 10-2mol/L������Ԫ���غ��֪��c(H2S)+c(HS-)=0.1mol/L-c(S2-)=0.1mol/L-5.7
10-2mol/L������Ԫ���غ��֪��c(H2S)+c(HS-)=0.1mol/L-c(S2-)=0.1mol/L-5.7![]() 10-2mol/L =0.043 mol/L������ΪKsp(MnS)= c(Mn2+)
10-2mol/L =0.043 mol/L������ΪKsp(MnS)= c(Mn2+)![]() c(S2-)����Mn2+��ʼ����ʱ��
c(S2-)����Mn2+��ʼ����ʱ�� 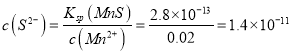 mol/L ����ͼ��֪��Һ��pH=5��
mol/L ����ͼ��֪��Һ��pH=5��
��3����HSO3-�ĵ��뷽��ʽΪ![]() ������HSO3-�ĵ���ƽ�ⳣ������ʽΪ
������HSO3-�ĵ���ƽ�ⳣ������ʽΪ![]()
![]() ����0.10 mol��L-1Na2SO3��Һ����Na2SO3��ȫ���룬�����Ӳ�����ˮ�⣬Ũ�����SO32-Ũ�Ƚ����������ӣ�SO32-����ˮ���HSO3-��OH-������OH-������Դ��SO32-ˮ���ˮ�ĵ��룬��c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)���۸��ݵ���ƽ�ⳣ������֪��H2SO3����ǿ��H2CO3�����ԣ�H2CO3����ǿ��HSO3-���ԣ�����ǿ�������ᣬ�����Ҫ�����ӷ���ʽΪ
����0.10 mol��L-1Na2SO3��Һ����Na2SO3��ȫ���룬�����Ӳ�����ˮ�⣬Ũ�����SO32-Ũ�Ƚ����������ӣ�SO32-����ˮ���HSO3-��OH-������OH-������Դ��SO32-ˮ���ˮ�ĵ��룬��c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)���۸��ݵ���ƽ�ⳣ������֪��H2SO3����ǿ��H2CO3�����ԣ�H2CO3����ǿ��HSO3-���ԣ�����ǿ�������ᣬ�����Ҫ�����ӷ���ʽΪ![]() ��
��

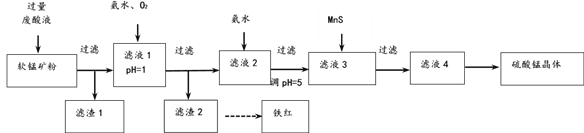
����Ŀ�������̿����Ҫ�ɷ�MnO2������SiO2 ��Fe2O3��Al2O3��Cu2(OH)2CO3�ĵ����ʣ�����ϴ������Һ����1mol/LH2SO4��FeSO4��Һ���������������̺����죨Fe2O3��������������
Mn(OH)2 | Fe(OH)2 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | |
��ʼ����ʱ | 8.3 | 6.3 | 4.7 | 3.4 | 2.7 |
��ȫ����ʱ | 9.8 | 8.3 | 6.7 | 4.4 | 3.2 |
��1�������ʵ����̿�ʹ��ǰ�轫����飬Ŀ����______��
��2������1�к��е���Ҫ������_______��
��3����Һ1�У��Ӱ�ˮ������ҺpH��3.2��ͨ��O2����Ӧ�����ӷ���ʽ��_______������H2O2����O2���Ƿ������������___________��
��4�����̿�������������������Һ��Ӧ�����ӷ���ʽ��_________��
��5����Һ3�м������ܵ����MnS��Ŀ���ǣ������ӷ���ʽ��ʾ��_________��
��6�����ؽᾧ������Һ4�л�ȡ�����̾���IJ����ǣ�__________��
����Ŀ��������һ����Ҫ�Ļ���ԭ�ϣ���ҵ����N2��H2�ϳ�NH3���ּ�֪N2(g)��H2(g)��Ӧ����1 molNH3(g)�����������仯ʾ��ͼ����ͼ����N-H������Ϊ( )

��ѧ�� | H-H | N��N |
���ܣ�kJ/mol�� | 436 | 946 |
A. 248kJ/mol B. 391kJ/mol C. 862kJ/mol D. 431kJ/mol
����Ŀ��(1)ij��ѧ��ȤС�����������Լ������ۡ�п�ۡ�0.1 mol��L1 FeCl3��Һ��0.1 mol��L1 FeCl2��Һ��KSCN��Һ��������ˮ��̽��Fe2+��Fe3+�������ԡ���ԭ�ԣ�������ʵ����۽��һЩ���⡣
���������Լ�д������Fe2+���л�ԭ�Եķ�Ӧ�Ļ�ѧ����ʽ��_________________________________��
�����ʵ�鷽����������б���
̽������ | ʵ�鷽�� | ʵ������ |
̽��Fe3+���������� | ȡ����0.1 mol��L1 FeCl3��Һ������Һ�м����������ۣ��ټ�������KSCN��Һ | �������ۺ���Һ��ɫ��Ϊ________������KSCN��Һ����Һ________ |
�۸���ȤС��Ϊ˵����Fe2+���������ԡ����������FeCl2��Һ�м���п�ۣ��۲�ʵ������ķ������÷�Ӧ�����ӷ���ʽΪ_________________________________________��
(2)ij��Ӧ�з�Ӧ������������Fe3+��Mn2+��H+��![]() ��H2O��һ��δ֪����X����֪
��H2O��һ��δ֪����X����֪![]() �ڷ�Ӧ�еõ����ӣ���X������____________���÷�Ӧ�����ӷ���ʽ��____________________________��
�ڷ�Ӧ�еõ����ӣ���X������____________���÷�Ӧ�����ӷ���ʽ��____________________________��
(3)��һ������������Ʒ����5 mol��L1������140 mLǡ����ȫ�ܽ⣬������Һ������ͨ���0.56 L����(��״��)��Ӧ��ʹFe2+ȫ��ת��ΪFe3+�����������Ϊ________��