��Ŀ����
����Ŀ���û�ԭ�����Ʊ���ï�������˽����л��������о�������������ï��������������һ����Ҫ��������ṹ��ͼ��ʾ��

��1����̬Feԭ�Ӽ۲�����Ų�ʽ��_______��
��2����֪��ï���������۵���176�����е���249����������ˮ���������ȷ¡���ͪ���л��ܼ����ݴ˿��ƶ϶�ï������������Ϊ_______���塣
��3����ï����������̼ԭ�ӵ��ӻ���ʽΪ_________��H��C��N��O����Ԫ�صĵ縺���ɴ�С��˳����_________��
��4��̼����Ԫ�ض�Ӧ������⻯��ֱ���CH4��NH3����ͬ������CH4�ķе��NH3�ķе�_______������������������������Ҫԭ����_______��
��5���⡢����������Ԫ�ذ���4:2:3��ԭ�Ӹ������γ����ӻ���������ӻ������У������ӿռ乹����_______��1 mol�����Ӻ�����������ĿΪ_______��
��6�����������γ�һ�ִ��Բ��ϣ��侧����ͼ��ʾ���ô��Բ��ϵĻ�ѧʽΪ_______����֪��������Ϊa nm����þ����ܶȵļ���ʽΪ����_______g/cm3����NA��ʾ�����ӵ�������ֵ����
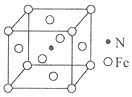
���𰸡� 3d64s2 ���� sp2��sp3 O>N>C>H �� �����Ӽ������� ���������� 3NA��1.806��1024 Fe4N 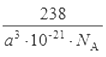
��������������Ҫ�������ʽṹ��
��1����̬Feԭ�Ӽ۲�����Ų�ʽ��3d64s2��
��2����ï���������۵㡢�е�ϵͣ�������ˮ���������ȷ¡���ͪ���л��ܼ����ݴ˿��ƶ϶�ï������������Ϊ���Ӿ��塣
��3����ï����������˫��̼ԭ�ӵ��ӻ���ʽΪsp2������̼ԭ�ӵ��ӻ���ʽΪsp3���ǽ����ԣ�H<C<N<O����������Ԫ�صĵ縺���ɴ�С��˳����O>N>C>H��
��4��̼����Ԫ�ض�Ӧ������⻯��ֱ���CH4��NH3����ͬ������CH4�ķе��NH3�ķе�ͣ���Ҫԭ���ǰ����Ӽ���������
��5���⡢����������Ԫ�ذ���4:2:3��ԭ�Ӹ������γ����ӻ�����NH4NO3�������ӻ������У������ӿռ乹�������������Σ�1 mol�����Ӻ�����������ĿΪ3NA��1.806��1024��
��6����������1����ԭ�Ӻ�4����ԭ�ӣ����ǵ����ԭ������֮��Ϊ238���ô��Բ��ϵĻ�ѧʽΪFe4N���þ������Ϊa3 ��10-21cm3������Ϊ238g/NA����þ����ܶȵļ���ʽΪ��=![]() g/cm3��
g/cm3��

����Ŀ��(1)ij��ѧ��ȤС�����������Լ������ۡ�п�ۡ�0.1 mol��L1 FeCl3��Һ��0.1 mol��L1 FeCl2��Һ��KSCN��Һ��������ˮ��̽��Fe2+��Fe3+�������ԡ���ԭ�ԣ�������ʵ����۽��һЩ���⡣
���������Լ�д������Fe2+���л�ԭ�Եķ�Ӧ�Ļ�ѧ����ʽ��_________________________________��
�����ʵ�鷽����������б���
̽������ | ʵ�鷽�� | ʵ������ |
̽��Fe3+���������� | ȡ����0.1 mol��L1 FeCl3��Һ������Һ�м����������ۣ��ټ�������KSCN��Һ | �������ۺ���Һ��ɫ��Ϊ________������KSCN��Һ����Һ________ |
�۸���ȤС��Ϊ˵����Fe2+���������ԡ����������FeCl2��Һ�м���п�ۣ��۲�ʵ������ķ������÷�Ӧ�����ӷ���ʽΪ_________________________________________��
(2)ij��Ӧ�з�Ӧ������������Fe3+��Mn2+��H+��![]() ��H2O��һ��δ֪����X����֪
��H2O��һ��δ֪����X����֪![]() �ڷ�Ӧ�еõ����ӣ���X������____________���÷�Ӧ�����ӷ���ʽ��____________________________��
�ڷ�Ӧ�еõ����ӣ���X������____________���÷�Ӧ�����ӷ���ʽ��____________________________��
(3)��һ������������Ʒ����5 mol��L1������140 mLǡ����ȫ�ܽ⣬������Һ������ͨ���0.56 L����(��״��)��Ӧ��ʹFe2+ȫ��ת��ΪFe3+�����������Ϊ________��
����Ŀ���ϳɰ��������ѧ�����ϵ�һ���ش�ͻ�ƣ�����ᷢչ����������˾�����
��1��450��ʱ����һ�����Ϊ2L�ĺ����ܱ������г���0.4 mol N2��0.6 mol H2��10minʱ�ı�ijһ����������÷�Ӧ������N2��H2��NH3�����ʵ�����ʱ��仯���±���
ʱ�� ���ʵ��� | 5 min | 10 min | 15 min | 20 min | 25 min |
n(N2)/mol | 0.36 | 0.35 | 0.275 | 0.25 | 0.25 |
n(H2)/mol | 0.48 | 0.45 | 0.225 | 0.15 | 0.15 |
n(NH3)/mol | 0.08 | 0.1 | 0.25 | 0.30 | 0.30 |
��5��10 min�ڣ�����NH3��ƽ����Ӧ������_______ mol/(L��min)��
����������Ϊ�жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������_______������ĸ��ţ���
A��v(N2)��=3v(H2)�� B��������ѹǿ���ֲ���
C�������ڻ��������ܶȱ��ֲ��� D�������ڻ�������ƽ����Է���������
�۵�10 minʱ�ı��������ʹ���˸�Ч������������_______��
��2���ϳɰ��ķ�Ӧԭ��Ϊ��N2(g)+3H2(g)![]() 2NH3(g) ��H��
2NH3(g) ��H��
��ػ�ѧ�������������£�
��ѧ�� | H��H | N��N | N��H |
E /��kJ/mol�� | 436 | 946 | 391 |
�ɴ˼�����H=_______kJ/mol�������£��ϳɰ���Ӧ_______�����������������������Է����С���֪�ϳɰ���ӦN2(g)+3H2(g)![]() 2NH3(g)�Ļ��Ea1=499kJ/mol���ɴ˼��㰱�ֽⷴӦ2NH3(g)
2NH3(g)�Ļ��Ea1=499kJ/mol���ɴ˼��㰱�ֽⷴӦ2NH3(g)![]() N2(g)+3H2(g)�Ļ��Ea2=_______kJ/mol��
N2(g)+3H2(g)�Ļ��Ea2=_______kJ/mol��
��3����֪������ij������������������Ҫ����������������Ӧ��
��Ӧ����4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ��H =��906kJ/mol
4NO(g)+6H2O(g) ��H =��906kJ/mol
��ӦII��4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ��H =��1267kJ/mol
2N2(g)+6H2O(g) ��H =��1267kJ/mol
�ٸ������£�N2(g)+O2(g)![]() 2NO(g) ��H = _______kJ/mol
2NO(g) ��H = _______kJ/mol
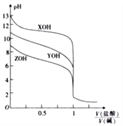
��Ϊ���������Է�Ӧ��ѡ���ԣ���1 L�ܱ������г���1 mol NH3��2 mol O2������й����ʵ����ʵ������¶ȱ仯��ͼ��ʾ��

�ô����ڽϵ��¶�ʱ��Ҫѡ��Ӧ_______��������Ӧ��������ӦII������520��ʱ����Ӧ����ƽ�ⳣ��K=_______��ֻ����ʽ�����㣩��