题目内容
2.(1)取6.32g KMnO4加热一段时间后,收集到560mL O2(标准状况下),将剩余固体投入到足量的浓HCl溶液中并加热,充分反应后固体完全溶解(溶液中Mn元素全部以Mn2+形式存在)并收集到V mL Cl2(标准状况下).求V=1120L(2)铜和镁的合金4.70克完全溶于浓硝酸中,若反应中硝酸被还原只产生4480mL的NO2气体和224mL的NO气体(都已经折算成标准状况).在反应后的溶液中加入足量的NaOH溶液,生成沉淀的质量为8.51g.
分析 (1)整个反应过程中,得电子的是Mn元素,失电子的是O、Cl两种元素,根据电子守恒来计算;
(2)最终生成沉淀为Cu(OH)2和Mg(OH)2,根据电荷守恒可知,金属失去电子物质的量等于沉淀中氢氧根的物质的量,根据电子转移守恒计算金属失去电子物质的量,沉淀质量等于金属质量与氢氧根离子质量之和.
解答 解:(1)整个反应过程中,得电子的是Mn元素,失电子的是O、Cl两种元素,设根据电子守恒:$\frac{6.32g}{158g/mol}$(7-2)=$\frac{0.56L}{22.4L/mol}$×2×(2-0)+$\frac{0.001V}{22.4}$mol×2×(1-0),解得V=1120mL,故答案为:1120L;
(2)4.48L的 NO2气体的物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,0.224L的NO气体物质的量为$\frac{0.224L}{22.4L/mol}$=0.01mol,根据电子转移守恒,金属失去电子物质的量0.2mol×1+0.01mol×3=0.23mol,最终生成沉淀为Cu(OH)2和Mg(OH)2,根据电荷守恒可知,金属失去电子物质的量等于沉淀中氢氧根的物质的量,故沉淀质量为4.6g+0.23mol×17g/mol=8.51g,故答案为:8.51g.
点评 本题考查混合物计算,侧重解题方法与分析思维能力的考查,注意利用守恒法解答,难度中等.

练习册系列答案
相关题目
8.下列有关化学用语表示正确的是( )
| A. | ${\;}_{8}^{18}$O2-离子结构示意图: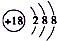 | B. | 四氯化碳分子的比例模型: | ||
| C. | 次氯酸的电子式: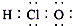 | D. | 中子数为16的硫离子:${\;}_{16}^{32}$S2- |
12.化学与生产、生活、社会密切相关,下列有关说法中错误的是( )
| A. | 糖类、油脂、蛋白质、无机盐和水均是动物性和植物性食物中的基本营养物质 | |
| B. | 84消毒液可用于环境消毒,医用酒精可用于皮肤消毒,其原因在于可以使病毒和细菌体内的蛋白变性 | |
| C. | 加快开发太阳能、氢能等新能源有利于降低空气中PM2.5的含量 | |
| D. | “忽闻还上有仙山,山在虚无缥缈间”的海市蜃楼现象的形成与胶体性质有关 |
7.X、Y、Z、W、R是原子序数依次增大的四种短周期元素,W的焰色反应呈黄色,X、W是同主族元素,可形成离子化合物WX,R与Z属于同一主族,Y、Z两种元素形成化合物是光化学污染的魁首,下列说法不正确的是( )
| A. | 原子半径:W>R>Y>Z>X | |
| B. | X、Y和Z三种元素形成化合物中一定含有离子键和共价键 | |
| C. | 气态氢化物的稳定性:Z>Y>R | |
| D. | Y的最高价氧化物对应的水化物一定有强的氧化性 |
12.实验装置图完全正确的是( )
| A. | 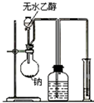 测量钠与乙醇反应生成H2的体积 | B. | 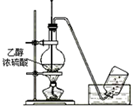 制取乙烯 | ||
| C. | 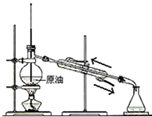 蒸馏石油 | D. | 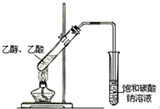 制取乙酸乙酯 |
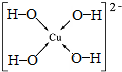 .
.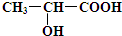
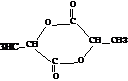 、
、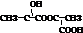 ;
; 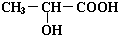 +2Na→
+2Na→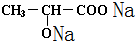 +H2↑;
+H2↑;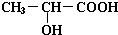 +Na2CO3=2
+Na2CO3=2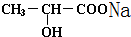 +CO2↑+H2O.
+CO2↑+H2O.