题目内容
5.将40g NaOH固体溶于水配成2L溶液,求所得氢氧化钠的溶液的物质的量浓度?若稀释到4L时,溶液的浓度是多少?分析 根据质量与物质的量的计算公式n=$\frac{m}{M}$计算溶质的物质的量,物质的量除以溶液的体积即得物质的量浓度.根据稀释定律,稀释前后NaOH的物质的量不变,根据c=$\frac{n}{V}$计算计算稀释后溶液浓度.
解答 解:40gNaOH的物质的量为n=$\frac{m}{M}$=$\frac{40g}{40g/mol}$=1mol,溶液的体积为2L,则溶液的物质的量浓度为c=$\frac{n}{v}$=$\frac{1mol}{2L}$=0.5mol/L,根据稀释定律,稀释前后NaOH的物质的量不变,故稀释后溶液浓度c=$\frac{n}{V}$=$\frac{1mol}{4L}$=0.25mol/L,
答:将40g NaOH固体溶于水配成2L溶液,该溶液中氢氧化钠的物质的量浓度是0.5mol/L,若稀释到4L时,溶液的浓度是0.25mol/L.
点评 本题考查物质的量浓度的计算,题目难度不大,注意有关公式的熟练运用.

练习册系列答案
相关题目
15.下列实验装置或操作能达到实验目的是( )
| A. | 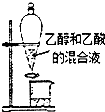 分离乙醇和乙酸 | B. |  制取乙酸乙酯 制取乙酸乙酯 | C. | 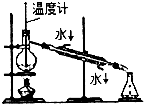 石油的蒸馏 石油的蒸馏 | D. | 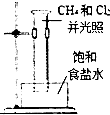 甲烷与氯气反应 |
19.下列各组混合物中,都能用分液漏斗分离的是( )
| A. | 乙酸乙酯和水 酒精和水 | B. | 汽油和水 苯和水 | ||
| C. | 菜籽油和水 甲酸和水 | D. | 苯和水 乙酸和乙醇 |
20.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,11.2L的CHCl3所含的分子数为0.5NA | |
| B. | 17g羟基(-OH)所含有的电子数是10NA | |
| C. | 9.2g甲苯和丙三醇的混合物中,含氢原子数目为0.8NA | |
| D. | 现有乙烯、丙烯的混合气体共28g,其中碳原子数为2NA |
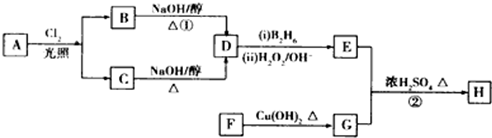
 .
. .
. .
.