题目内容
7.95℃时,纯水中H+的物质的量浓度为1×10-6 mol•L-1,若把0.01mol NaOH固体溶解于95℃水中配成1L溶液,则溶液的pH为( )| A. | 12 | B. | 10 | C. | 4 | D. | 2 |
分析 95℃时,纯水中c(H+)=c(OH-)=1×10-6mol•L-1,Kw=c(H+).c(OH-)=10-12,根据题意知,氢氧化钠浓度=$\frac{0.01mol}{1L}$=0.01mol/L,结合水的离子积常数计算溶液中氢离子浓度,再根据pH=-lgc(H+)计算.
解答 解:95℃时,纯水中c(H+)=c(OH-)=1×10-6mol•L-1,Kw=c(H+).c(OH-)=10-12,根据题意知,氢氧化钠浓度为:$\frac{0.01mol}{1L}$=0.01mol/L,则氢氧化钠溶液中c(H+)=$\frac{{K}_{W}}{c(O{H}^{-})}$=$\frac{1{0}^{-12}}{0.01}$mol/L=10-10 mol/L,
该氢氧化钠溶液的pH=-lgc(H+)=10,
故选B.
点评 本题考查了PH的简单计算,题目难度中等,明确氢氧化钠浓度的计算方法、水的离子积常数与氢离子氢氧根离子之间的关系是解本题关键,注意该温度下水的离子积常数不是10-14而是10-12,学生容易出现定向思维而导致错误.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
17.用铁片与稀硫酸反应制氢气时,下列措施能使氢气生成速率加大的是( )
| A. | 降温 | B. | 不用稀硫酸,改用98%浓硫酸 | ||
| C. | 加水稀释硫酸 | D. | 不用铁片,改用铁粉 |
15.下列实验装置或操作能达到实验目的是( )
| A. | 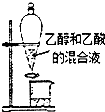 分离乙醇和乙酸 | B. |  制取乙酸乙酯 制取乙酸乙酯 | C. | 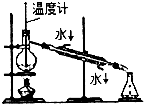 石油的蒸馏 石油的蒸馏 | D. | 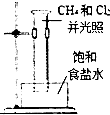 甲烷与氯气反应 |
2.下列有关苯的说法中不正确的是( )
| A. | 通常状况下,是无色、有特殊气味的液体 | |
| B. | 通常状况下,不能使溴水或酸性KMnO4溶液褪色 | |
| C. | 通常状况下,与浓硝酸混合则剧烈反应生成硝基苯 | |
| D. | 碳原子间的键是一种介于C-C和C=C之间的特殊的键 |
12.分析原子的杂化方式,并根据等电子体原理判断下列各组分子中的所有原子,或者处于同一平面,或者在一条直线上的是( )
| A. | C2H2、HClO、C2H6 | B. | CO2、N2O、HC≡C-NH2 | ||
| C. | C6H5CH3、C3H4、CH4 | D. | C6H6、C2H4、HCN |
19.在密闭容器中发生反应:C(s)+CO2(g)$\frac{\underline{\;高温\;}}{\;}$ 2CO(g),下列说法不正确的是( )
| A. | 将碳块磨成粉末可以加快反应速率 | |
| B. | 升高温度可以加快反应速率 | |
| C. | 容器体积不变时,向其中充入N2,反应速率不变 | |
| D. | 增加碳的质量可以加快反应速率 |