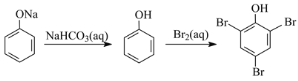
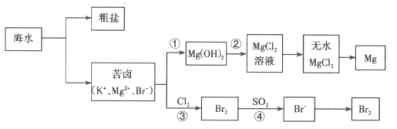
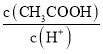题目内容
【题目】25℃条件下,用0.1molL-1的一元弱酸HR[已知:25℃时,Ka(HR)=1.7×10-5]溶液滴定10.00mL0.1molL-1一元碱MOH溶液,滴定过程中HR溶液的体积与溶液中lg![]() 的关系如图所示。下列说法正确的是( )
的关系如图所示。下列说法正确的是( )

A.25℃时,0.1molL-1的MOH溶液pH<13
B.a点消耗HR溶液的体积等于10.00mL
C.b点溶液中c(R-)>c(H+)>c(M+)>c(OH-)
D.25℃时,MR溶液中![]() =
=![]() ×10-9
×10-9
【答案】D
【解析】
A.由图可知![]() 的MOH溶液中
的MOH溶液中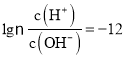 ,故
,故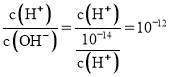 ,解得
,解得![]() ,溶液的
,溶液的![]() ,故A错误;
,故A错误;
B.由图像可知lg![]() ,
,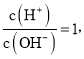 a点溶液呈中性,由于MOH是强碱,HR是弱酸,得到的是弱酸强碱盐,显碱性,若要使二者反应若呈中性,则HR溶液的体积大于
a点溶液呈中性,由于MOH是强碱,HR是弱酸,得到的是弱酸强碱盐,显碱性,若要使二者反应若呈中性,则HR溶液的体积大于![]() ,故B错误;
,故B错误;
C.b点初始溶液中MR和HR浓度相等,由于该点溶液呈酸性,故HR的电离程度大于![]() 的水解程度,因此离子浓度大小为
的水解程度,因此离子浓度大小为![]() ,故C错误;
,故C错误;
D.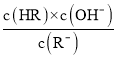 为
为![]() 的水解平衡常数表达式,
的水解平衡常数表达式,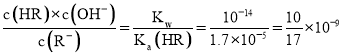 ,故D正确;
,故D正确;
答案选D。

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目