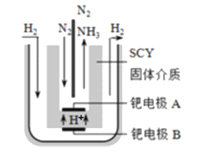
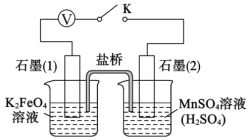
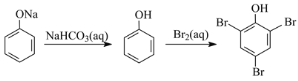
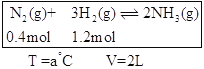题目内容
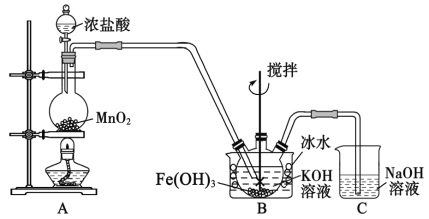
【题目】一种利用废干电池中黑色粉末(主要成分MnO2、炭粉及少量Hg2+、Pb2+等重金属盐)制备MnSO4晶体的工艺流程如图:
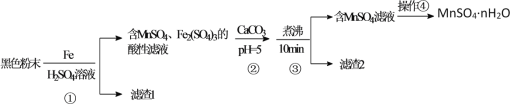
下列说法错误的是( )
A.反应①中1molFe至多还原1.5molMnO2
B.重金属主要在滤渣2中
C.步骤③煮沸可使沉淀颗粒长大,目的是便于固液分离
D.合理处理废旧电池有利于资源再利用并防止汞、铅等重金属污染
【答案】B
【解析】
黑色粉末(主要成分MnO2、炭粉及少量Hg2+、Pb2+等重金属盐)用浓硫酸溶解,并加入适量铁粉,过滤后所得滤渣1中主要是不溶于水的炭粉、和置换出的Hg、Pb等,滤液中主要含有MnSO4、Fe2(SO4)3,加入CaCO3并调节溶液pH=5左右,并加热煮沸,促进Fe3+水解生成Fe(OH)3,则过滤后滤渣2主要为Fe(OH)3,滤液主要含有MnSO4,滤液经蒸发浓缩并冷却结晶、过滤即可得到MnSO4nH2O;
A.用Fe和浓H2SO4溶解MnO2时发生反应的化学方程式为2Fe+3MnO2+6H2SO4=3MnSO4+Fe2(SO4)3+6H2O,反应中1molFe参加反应,被还原的MnO2是1.5mol,故A正确;
B.步骤①中同时发生Fe+Hg2+=Fe2++Hg、Fe+Pb2+=Fe2++Pb,则重金属Hg、Pb主要在滤渣1中,故B错误;
C.悬浊液中Fe(OH)3颗粒越大,越易与MnSO4溶液过滤分离,则步骤③煮沸使Fe(OH)3沉淀颗粒长大,目的是便于固液分离,故C正确;
D.锰等是重要金属资源,汞、铅等重金属能来得污染环境,则合理处理废旧电池有利于资源再利用并防止汞、铅等重金属污染,故D正确;
故答案为B。

练习册系列答案
相关题目