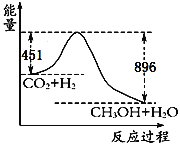
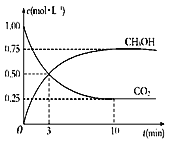
题目内容
【题目】某温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),发生H2(g)+CO2(g)CO(g)+H2O(g),其起始浓度如表所示。已知:平衡时甲中CO气体的浓度为0.006mol/L。下列判断不正确的是( )
起始浓度(mol/L) | 甲 | 乙 | 丙 |
c(H2) | 0.010 | 0.020 | 0.020 |
c(CO2) | 0.010 | 0.010 | 0.020 |
A.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
B.平衡时,甲、乙、丙中CO2的转化率有如下关系:乙>甲=丙=60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
D.改变条件使乙中温度降低,新平衡中H2的浓度增大,则正反应的△H>0
【答案】C
【解析】
A、比较甲、乙、丙起始量,丙的起始浓度最大,反应速率最快,达到平衡需要的时间最少,甲的浓度最少,反应速率最慢,故A正确;
B、丙相当于将两份甲压缩在一个容器中,相当于增大压强,但两边的计量数相等,平衡不移动,所以丙、甲中![]() 的转化率相等,平衡时甲中CO气体的浓度为0.006mol/L,即转化的CO2气体的浓度为0.006mol/L,二氧化碳的转化率=
的转化率相等,平衡时甲中CO气体的浓度为0.006mol/L,即转化的CO2气体的浓度为0.006mol/L,二氧化碳的转化率=![]() ×100%=60%,乙相当于在甲的基础上增加氢气的浓度,平衡正向移动,二氧化碳的转化率增大,则乙
×100%=60%,乙相当于在甲的基础上增加氢气的浓度,平衡正向移动,二氧化碳的转化率增大,则乙![]() 甲
甲![]() 丙
丙![]() ,故B正确;
,故B正确;
C、丙相当于将两份甲压缩在一个容器中,相当于增大压强,而平衡不移动,所以平衡是丙中各组分中各组分的浓度是甲的2倍,而甲中平衡时二氧化碳的浓度为![]() ,则丙中平衡时二氧化碳的浓度为
,则丙中平衡时二氧化碳的浓度为![]() ,故C错误;
,故C错误;
D、改变条件使乙中温度降低,新平衡中![]() 的浓度增大,说明平衡逆向移动,所以逆反应是放热反应,则正反应的
的浓度增大,说明平衡逆向移动,所以逆反应是放热反应,则正反应的![]() ,故D正确;
,故D正确;
故选C。

练习册系列答案
相关题目