题目内容
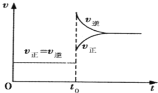
【题目】可逆反应:A(g)+B(g)![]() C(s)+D(g) △H<0,正、逆反应速率变化如图所示(υ代表反应速率,t代表时间),则t1时改变平衡的一个条件是
C(s)+D(g) △H<0,正、逆反应速率变化如图所示(υ代表反应速率,t代表时间),则t1时改变平衡的一个条件是
A.加入了正催化剂
B.加大了体系的压强
C.增加了体系的温度
D.加大了反应物的浓度
【答案】C
【解析】
A.加入了正催化剂,正、逆反应速率同等程度增大,平衡不移动,故A错误;
B.加大了体系的压强,正逆反应速率都增大,该反应为气体的物质的量减小的反应,平衡正向移动,正反应速率大于逆反应速率,与图像不符,故B错误;
C.该反应为放热反应,增加了体系的温度,平衡逆向移动,逆反应速率大于正反应速率,与图像吻合,故C正确;
D.加大了反应物的浓度,正反应速率突然增大,逆反应速率不变,与图像不符,故D错误;
故选C。

【题目】化学反应速率和限度与生产、生活密切相关。
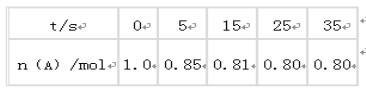
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大__min(填0~1、1~2、2~3、3~4、4~5),原因是___。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率___(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是___。
A.蒸馏水 B.KCl溶液C.KNO3溶液D.CuSO4溶液
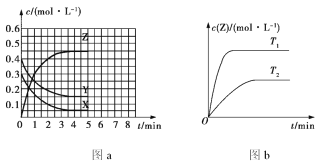
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。

①该反应的化学方程式是___。
②该反应达到平衡状态的标志是___。
A.Y的体积分数在混合气体中保持不变
B.2v(X)=3v(Z)
C.容器内气体压强保持不变
D.X、Y、Z三种气体的浓度之比为3:1:2
E.生成1molY的同时消耗2molZ
F.容器内气体的平均相对分子质量保持不变
③2min内Y的转化率为___。
【题目】某温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),发生H2(g)+CO2(g)CO(g)+H2O(g),其起始浓度如表所示。已知:平衡时甲中CO气体的浓度为0.006mol/L。下列判断不正确的是( )
起始浓度(mol/L) | 甲 | 乙 | 丙 |
c(H2) | 0.010 | 0.020 | 0.020 |
c(CO2) | 0.010 | 0.010 | 0.020 |
A.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
B.平衡时,甲、乙、丙中CO2的转化率有如下关系:乙>甲=丙=60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
D.改变条件使乙中温度降低,新平衡中H2的浓度增大,则正反应的△H>0