题目内容
【题目】根据要求完成下列各题。
(1)25℃时,向AgCl的悬浊液中加入KI固体,有黄色沉淀生成。说明Ksp(AgCl)___Ksp(AgI)(填“<”、“>”或“=”下同)。
(2)已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-。若浓硫酸与氢氧化钠溶液发生中和反应生成1mol水,则ΔH的数值___57.3kJ·mol-;若稀盐酸与氨水发生中和反应生成1mol水,则ΔH的数值___57.3kJ·mol-1。
(3)在化学反应里只有活化分子才可能发生化学反应,使普通分子变成活化分子所需提供的最低限度的能量叫活化能。根据如图回答问题。
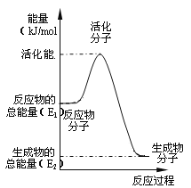
①图中所示反应是___(填“吸热”或“放热”)反应,该反应___(填“需要”或“不需要”)加热,该反应的△H=___(用含E1、E2的代数式表示)。
②已知热化学方程式:H2(g)+![]() O2(g)=H2O(g) △H=-241.8kJ·mol-1,该反应的活化能为167.2kJ·mol-1,则其逆反应的活化能为___。
O2(g)=H2O(g) △H=-241.8kJ·mol-1,该反应的活化能为167.2kJ·mol-1,则其逆反应的活化能为___。
【答案】> > < 放热 需要 E2-E1 409kJ/mol
【解析】
(1)根据沉淀转化的规律分析解答;
(2)浓硫酸溶于水放热,氨水的电离需要吸热,据此分析判断;
(3)①依据图象分析反应物的能量大于生成物的能量,且反应的活化能较大,结合反应的焓变=生成物的能量-反应物的能量分析判断;②根据焓变等于正逆反应的活化能之差计算。
(1)KSP(AgCl)>KSP(AgI),沉淀转化为溶解度更小的物质容易发生,因此向AgCl的悬浊液中加入KI溶液,沉淀由白色转化为黄色,故答案为:>;
(2)浓硫酸溶于水放热,因此浓硫酸与氢氧化钠溶液发生中和反应生成1mol水,放出的热量多于57.3kJ;氨水的电离需要吸热,因此稀盐酸与氨水发生中和反应生成1mol水,放出的热量少于57.3kJ,故答案为:>;<;
(3)①依据图象,反应物的能量大于生成物的能量,反应放热;该反应的活化能较大,引发反应需要加热,反应的焓变△H=生成物的能量-反应物的能量=(E2-E1)kJ/mol,故答案为:放热;需要;E2-E1;
②焓变等于正逆反应的活化能之差,则逆反应的活化能为167.2kJmol-1-(-241.8kJmol-1)=409.0 kJmol-1,故答案为:409.0 kJmol-1。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案【题目】某温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),发生H2(g)+CO2(g)CO(g)+H2O(g),其起始浓度如表所示。已知:平衡时甲中CO气体的浓度为0.006mol/L。下列判断不正确的是( )
起始浓度(mol/L) | 甲 | 乙 | 丙 |
c(H2) | 0.010 | 0.020 | 0.020 |
c(CO2) | 0.010 | 0.010 | 0.020 |
A.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
B.平衡时,甲、乙、丙中CO2的转化率有如下关系:乙>甲=丙=60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
D.改变条件使乙中温度降低,新平衡中H2的浓度增大,则正反应的△H>0