题目内容
11.已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+.下列有关的离子方程式正确的是( )| A. | 向能使PH试纸显深蓝色的溶液中通入少量二氧化碳:OH-+CO2═HCO3- | |
| B. | 向NaClO溶液中加入浓氢溴酸:ClO-+2H++2 Br-═Cl-+Br2+H2O | |
| C. | 向NaClO溶液中通入少量二氧化碳:2ClO-+CO2+H2O═2HClO+CO32- | |
| D. | 向FeBr2溶液中滴加少量HClO溶液:2Fe2++HClO═2Fe3++Cl-+OH- |
分析 A.PH试纸显深蓝色的溶液,溶液呈碱性;
B.依据氧化还原反应中的氧化性强弱规律解答;
C.酸性H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳生成HCO3-;
D.氧化性:HClO>Cl2>Br2>Fe3+,次氯酸少量,先氧化二价铁离子.
解答 解:A.PH试纸显深蓝色的溶液,溶液呈碱性,碱性溶液中氢氧根离子与碳酸氢根离子反应,不能生成碳酸氢根离子,故A错误;
B.由题意知次氯酸氧化性强于溴单质,所以向NaClO溶液中加入浓氢溴酸反应的离子方程式:ClO-+2H++2Br-═Cl-+Br2+H2O,故B正确;
C.酸性H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳生成HCO3-,故C错误;
D.氧化性:HClO>Cl2>Br2>Fe3+,次氯酸少量,先氧化二价铁离子,所以向FeBr2溶液中滴加少量HClO溶液,离子方程式:2Fe2++HClO═2Fe3++Cl-+OH-,故D正确;
故选:BD.
点评 本题考查了离子方程式的书写,明确酸性强弱顺序、氧化性强弱顺序是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.化学知识渗透到人类生活的各个方面.下列说法正确的是( )
| A. | 为提高农作物的产量和质量,应大量使用化肥和农药 | |
| B. | 油脂和汽油都属于酯类,都能用作工业制肥皂 | |
| C. | 纯碱可用于生成普通玻璃,日常生活中也可能用初年溶液来除去物品表面的油污 | |
| D. | 雾霾严重影响了人们的正常生活,为改善空气质量,可以加高工厂的烟囱,使灰尘和废气远离地表 |
2.下列说法不正确的是( )
| A. | 硅是半导体材料,可用于制备光导纤维 | |
| B. | Na2O2能与CO2反应,可用作呼吸面具的供氧剂 | |
| C. | 明矾能水解生成Al(OH)3胶体,可用作净水剂 | |
| D. | Al2O3熔点高,可用于制作耐高温仪器 |
3.下列关于实验原理或操作的叙述中,正确的是( )
| A. | 吸入氯气、氯化氢气体时,可吸入少量酒精或乙醚的混合蒸气解毒 | |
| B. | 移液管放液时,将移液管稍倾斜放入直立的容器中,并使管尖与容器内壁接触,松开食指使溶液全部流出,数秒后,取出移液管 | |
| C. | 生物体死亡后,体内含有的碳-14会逐渐减少,因此可通过测量生物体遗骸中碳-14的含量,来计算它存活的年代.碳-14减少的变化为化学变化 | |
| D. | 当用电解法除去溶液中的Cr2O72-离子时,因其具有强氧化性易得电子,故可在阴极直接放电生成Cr3+,最后生成Cr(OH)3沉淀除去 |
20.下列物质的分类错误的是( )
| A. | 水、二氧化硫和干冰都属氧化物 | B. | H2SO4、HNO3和H2CO3都属于酸 | ||
| C. | KNO3、CuSO4和NH4Cl都属于盐 | D. | 烧碱、纯碱、熟石灰都属于碱 |
1.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 2.4g Mg与N2完全反应,转移电子数都是0.3NA | |
| B. | 1mol白磷分子中含有P-P键数为1.5NA | |
| C. | 1.7gH2O2中含有的电子数为0.9NA | |
| D. | 在18g 18O2中含有2NA个氧原子 |
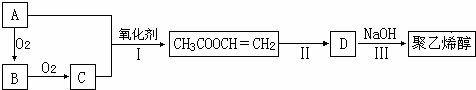
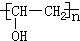 ;检验B常用的试剂为银氨溶液或新制氢氧化铜悬浊液;
;检验B常用的试剂为银氨溶液或新制氢氧化铜悬浊液;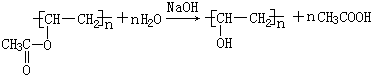 .
. ,Z由两个相同基团构成,该基团的名称是羟基.
,Z由两个相同基团构成,该基团的名称是羟基.