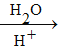题目内容
【题目】钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。完成下列计算:
(1)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生40.32 L(标准状况下)氮气,至少需要叠氮化钠________ g。
(2)钠—钾合金可在核反应堆中用作热交换液。5.05 g钠—钾合金溶于200 mL水生成0.075 mol氢气。
①计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化)。________
②计算并确定该钠-钾合金的化学式。______________
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液。向该溶液中通入二氧化碳,有下列反应:2NaAl(OH)4+CO2―→2Al(OH)3↓+Na2CO3+H2O,己知通入二氧化碳336 L(标准状况下),生成24 mol Al(OH)3和15 mol Na2CO3,若通入溶液的二氧化碳为112 L(标准状况下),计算生成的Al(OH)3和Na2CO3的物质的量之比。_____________
【答案】78 0.75(mol·L-1) NaK2 4∶5
【解析】
(1)反应的方程式为2NaN3![]() 2Na+3N2↑,根据方程式计算;
2Na+3N2↑,根据方程式计算;
(2)结合反应的方程式2Na+2H2O═2NaOH+H2↑、2K+2H2O═2KOH+H2↑计算;
(3)根据通入336L二氧化碳生成氢氧化铝的物质的量,结合方程式计算与NaAl(OH)4反应生成的碳酸钠的物质的量,进而计算溶液中氢氧化钠反应生成碳酸钠的物质的量;根据n=![]() 计算112L二氧化碳的物质的量,根据碳元素守恒计算112L二氧化碳反应生成碳酸钠的物质的量,减去氢氧化钠反应生成的碳酸钠可得112L二氧化碳与NaAl(OH)4反应生成的碳酸钠的物质的量,结合方程式计算生成Al(OH)3的物质的量,据此解答。
计算112L二氧化碳的物质的量,根据碳元素守恒计算112L二氧化碳反应生成碳酸钠的物质的量,减去氢氧化钠反应生成的碳酸钠可得112L二氧化碳与NaAl(OH)4反应生成的碳酸钠的物质的量,结合方程式计算生成Al(OH)3的物质的量,据此解答。
(1)40.32 L(标准状况下)氮气的物质的量为![]() =1.8mol,反应的方程式为2NaN3
=1.8mol,反应的方程式为2NaN3![]() 2Na+3N2↑,则参加反应的叠氮化钠的质量为1.8mol×
2Na+3N2↑,则参加反应的叠氮化钠的质量为1.8mol×![]() ×65g/mol=78g;
×65g/mol=78g;
(2)设钠、钾的物质的量分别为a、b,反应的方程式为2Na+2H2O═2NaOH+H2↑、2K+2H2O═2KOH+H2↑,则a+b=0.075mol×2=0.15mol,该溶液中氢氧根离子的物质的量浓度是![]() =0.75mol/L,且23a+39b=5.05(质量守恒),解之得a=0.050mol,b=0.10mol,n(Na):n(K)=1:2,该钠﹣钾合金化学式为NaK2;
=0.75mol/L,且23a+39b=5.05(质量守恒),解之得a=0.050mol,b=0.10mol,n(Na):n(K)=1:2,该钠﹣钾合金化学式为NaK2;
(3)通入336L二氧化碳生成24mol Al(OH)3,由2NaAl(OH)4+CO2→2Al(OH)3↓+Na2CO3+H2O可知,该反应生成的碳酸钠的物质的量=24mol×![]() =12mol,故溶液中氢氧化钠反应生成碳酸钠的物质的量=15mol﹣12mol=3mol;112L二氧化碳的物质的量=
=12mol,故溶液中氢氧化钠反应生成碳酸钠的物质的量=15mol﹣12mol=3mol;112L二氧化碳的物质的量=![]() =5mol,根据碳元素守恒可知112L二氧化碳反应生成碳酸钠的物质的量=5mol,故112L二氧化碳与NaAl(OH)4反应生成的碳酸钠的物质的量=5mol﹣3mol=2mol,结合方程式可知,112L二氧化碳反应生成Al(OH)3的物质的量=2mol×2=4mol,故生成的Al(OH)3和Na2CO3的物质的量之比=4mol:5mol=4:5。
=5mol,根据碳元素守恒可知112L二氧化碳反应生成碳酸钠的物质的量=5mol,故112L二氧化碳与NaAl(OH)4反应生成的碳酸钠的物质的量=5mol﹣3mol=2mol,结合方程式可知,112L二氧化碳反应生成Al(OH)3的物质的量=2mol×2=4mol,故生成的Al(OH)3和Na2CO3的物质的量之比=4mol:5mol=4:5。

 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案【题目】由下列实验及现象推出的相应结论正确的是
选项 | 实验 | 现象 | 结论 |
A | 2 mL0.01mol·L-1的KI溶液中滴入等体积等浓度的FeCl3溶液,将充分反应后的溶液分三份,一份滴入K3[Fe(CN)6]溶液,第二份滴入KSCN溶液,第三份滴入淀粉溶液 | 滴入K3[Fe(CN)6]溶液后产生蓝色沉淀;滴入KSCN溶夜后变血红色;滴入淀粉溶液后溶液变蓝 | KI溶液和FeCl3溶液发生反应:2Fe3++2I- |
B | 向稀硫酸中加入铜片,然后通入氧气加热 | 先无明显现象,通入氧气加热后溶液变蓝 | 氧化性:稀硫酸>Cu2+ |
C | 向浓度均为0.1 mol·L-1的Na2SO3和Na2SiO3溶液中分别滴加酚酞 | Na2SiO3溶液红色更深 | 非金属性:Si<S |
D | 将几滴等浓度的FeCl3溶液、AlCl3溶液同时滴入足量等浓度的NaOH溶液中 | 只产生红褐色沉淀 | Ksp[Al(OH)3]>K sp[Fe(OH)3] |
A. A B. B C. C D. D
【题目】2019年诺贝尔化学奖授予美国和日本的三位科学家,以表彰他们在锂离子电池领域的贡献。某种锂离子电池的工作原理如图所示,工作原理为:LiCoO2+C6![]() Li1-xCoO2+LixC6
Li1-xCoO2+LixC6
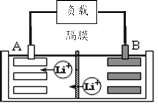
(1)该锂离子电池工作时A为____极,B的电极反应式为____。
(2)废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过实验方法回收钴、锂,实现废旧电池的资源化。
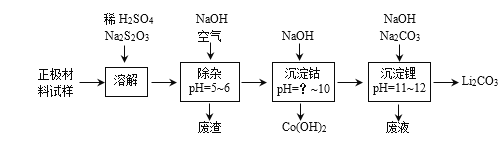
下表列出了几种离子生成氢氧化物沉淀的pH(“开始沉淀”的pH按金属离子浓度为0.1mol·L-1,“沉淀完全”是指溶液中离子浓度低于1.0×10-5 mol·L-1):
Al3+ | Fe3+ | Fe2+ | Co2+ | |
开始沉淀的pH | 4.0 | 2.7 | 7.6 | 7.0 |
沉淀完全的pH | 5.2 | 3.7 | 9.6 | ? |
①在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中反应的化学方程式为____。
②除杂过程中,通空气将Fe2+氧化为Fe3+的目的是____。
③沉钴过程中,须调节溶液的pH不低于____。