题目内容
【题目】下图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液。挤压胶管的胶头,下列与实验事实不相符的是
A.CO2(NaHCO3溶液) 无色喷泉B.NH3(H2O含酚酞) 红色喷泉
C.CO2(NaOH溶液) 无色喷泉D.HCl(AgNO3溶液) 白色喷泉
【答案】A
【解析】
A.选项中NaHCO3与CO2不反应,烧瓶内的压强不变,不能形成喷泉,A错误;
B.选项中氨气溶于水后,烧瓶中的压强减小,反应生成的氨水显碱性,能使酚酞试液变红色,形成红色喷泉,B正确;
C.选项中二氧化碳被氢氧化钠溶液吸收后,烧瓶中的压强减小,能够形成无色喷泉,C正确;
D.选项中硝酸银能和盐酸反应生成白色沉淀氯化银,烧瓶中的压强减小,能够形成白色喷泉,D正确。
故与试验事实不相符的是选项A。

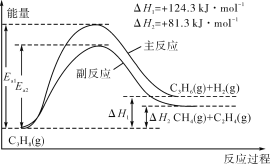
【题目】以下是处于研究阶段的“人工固氮”的新方法.N2在催化剂表面与水发生反应:
2N2(g)+6H2O(l)4NH3(g)+3O2(g) △H="+" 1530.4kJ/mol;完成下列填空:
(1)该反应平衡常数K的表达式_______.
(2)上述反应达到平衡后,保持其他条件不变,升高温度,重新达到平衡,则______.
a.平衡常数K增大
b.H2O的浓度减小
c.容器内的压强增大
d.v逆(O2)减小
(3)研究小组分别在四个容积为2升的密闭容器中,充入N21mol、H2O 3mol,在催化剂条件下进行反应3小时.实验数据见下表:
序号 | 第一组 | 第二组 | 第三组 | 第四组 |
t/℃ | 30 | 40 | 50 | 80 |
NH3生成量/(10﹣6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
第四组实验中以NH3表示反应的速率是_____,与前三组相比,NH3生成量最小的原因可能是______.
(4)氨水是实验室常用的弱碱.
①往CaCl2溶液中通入CO2至饱和,无明显现象.再通入一定量的NH3后产生白色沉淀,此时溶液中一定有的溶质是_____.请用电离平衡理论解释上述实验现象________________________.
②向盐酸中滴加氨水至过量,该过程中离子浓度大小关系可能正确的是______.
a.c(C1﹣)=c(NH4+)>c(H+)=c(OH﹣)
b.c(C1﹣)>c(NH4+)=c(OH﹣)>c(H+)
c.c(NH4+)>c(OH﹣)>c(C1﹣)>c(H+)
d.c(OH﹣)>c(NH4+)>c(H+)>c(C1﹣)
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气标准状况,实验记录如表累计值:
时间 | 1 | 2 | 3 | 4 | 5 |
氢气体积 | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大__(填0~1、1~2、2~3、3~4、4~5min)。反应开始后反应速率先增大的原因是__。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率___(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入少量的下列溶液以减慢反应速率,你认为不可行的是__。
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。

①该反应的化学方程式是__。
②该反应达到平衡状态的标志是__。
A.X、Y、Z的反应速率相等
B.X、Y的反应速率比为3:1
C.容器内气体压强保持不变
D.生成2mol Z的同时生成3mol X