题目内容
12.下列物质不是从海水中提取的是( )| A. | 铝 | B. | 镁 | C. | 液溴 | D. | 重水 |
分析 海洋是人类的自然资源宝库,海水中储量可观的化学元素有80多种,形成工业规模的产品主要有食盐、镁、溴、碘等.碘和溴可以在海带、海藻等海洋植物中提取;镁在海水中以氯化镁形式存在.
解答 解:海水中富含溴、镁、碘等元素,可从海水中获取镁、液溴,海水中富含重水,则B、C、D正确;
铝在自然界中主要以铝土矿的形成存在,主要从陆地上获取矿物原料,则A错误.
故选A.
点评 本题考查了海水资源的应用,为高频考点,学习中主要把握海水提取氯化钠、钠、氯气、溴单质的工业生产流程,综合性强,需要准确掌握反应原理,难度不大.

练习册系列答案
相关题目
2.向硝酸钠溶液中加入铜粉不发生反应,若再加入某种盐,则铜粉可以逐渐溶解,符合此条件的盐是( )
| A. | ZnSO4 | B. | NaHCO3 | C. | NaHSO4 | D. | Fe(NO3)2 |
7.相关化学用语表示正确的是( )
| A. | NH4Br的电子式: | |
| B. | S原子的结构示意图: | |
| C. | 次氯酸的电子式: | |
| D. | 原子核内有18个中子的氯原子:${\;}_{17}^{35}$Cl |
17.短周期元素R、W、X、Y、Z的原子序数依次增大,R原子的最外层电子数是其内层电子数的2倍,X元素的焰色反应呈黄色,W元素和Z元素同主族,且Z元素的核电荷数是W的2倍,Y是地壳中除氧外含量最多的非金属元素.下列说法不正确的是( )
| A. | W与X形成的两种化合物中阴、阳离子的个数比均为1:2 | |
| B. | Y、R、Z最高价氧化物对应水化物的酸性强弱顺序:Z>R>Y | |
| C. | W的氢化物熔沸点比Z的氢化物熔沸点低 | |
| D. | Y与R形成的化合物YR的熔点高、硬度大 |
4.下表给出14-17号元素的一些性质,请回答:
(1)它们所形成的氢化物中稳定性最差的是SiH4,还原性最差的是HCl.
(2)四种元素的非金属性随着元素原子序数的递增而逐渐增强,试从原子结构的角度加以解释四种元素原子的电子层数虽相同,但最外层电子数依次增加,随着核电荷数依次递增,原子半径依次减小,核对外层电子的引力逐渐增大,得电子能力逐渐增强,因此,非金属性逐渐增强.
(3)一定条件下,反应H2S+Cl2=2HCl+S能否发生?简述理由.能够发生;因非金属性Cl>S,氧化性Cl2>S,故Cl2能置换出H2S的硫.
| 14Si | 15P | 16S | 17Cl | |
| 单质与H2 反应的条件 | 高温 | 磷蒸气与 H2能反应 | 加热 | 光照或点燃 时发生爆炸 |
| 最高价氧化 物的水化物 | H4SiO4 弱酸 | H3PO4 中强酸 | H2SO4 强酸 | HClO4 最强含氧酸 |
(2)四种元素的非金属性随着元素原子序数的递增而逐渐增强,试从原子结构的角度加以解释四种元素原子的电子层数虽相同,但最外层电子数依次增加,随着核电荷数依次递增,原子半径依次减小,核对外层电子的引力逐渐增大,得电子能力逐渐增强,因此,非金属性逐渐增强.
(3)一定条件下,反应H2S+Cl2=2HCl+S能否发生?简述理由.能够发生;因非金属性Cl>S,氧化性Cl2>S,故Cl2能置换出H2S的硫.
1.在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A. | 加水稀释$\frac{c(O{H}^{-})}{c({H}^{+})}$增大的溶液:K+、Na+、SO42-、AlO2- | |
| B. | 常温下$\frac{{K}_{W}}{c({H}^{+})}$=0.1 mol/L的溶液:K+、Na+、SiO32-、NO3- | |
| C. | 铁片加入产生气泡的溶液:Na+、NH4+、I-、NO3- | |
| D. | NaHCO3溶液:K+、Na+、SO42-、Al3+ |
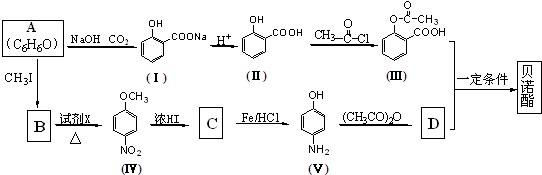
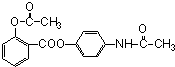
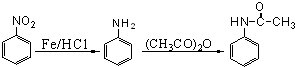
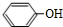 ;
; 或
或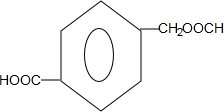 ;
;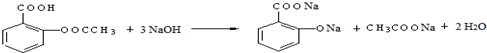 ;
;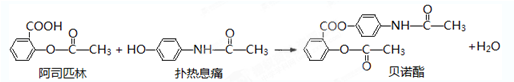 .
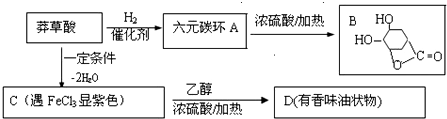
.
 .
.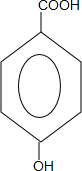 +CH3CH2OH$→_{△}^{浓硫酸}$H20+
+CH3CH2OH$→_{△}^{浓硫酸}$H20+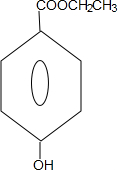 .
.