题目内容
7.相关化学用语表示正确的是( )| A. | NH4Br的电子式: | |
| B. | S原子的结构示意图: | |
| C. | 次氯酸的电子式: | |
| D. | 原子核内有18个中子的氯原子:${\;}_{17}^{35}$Cl |
分析 A.溴化铵的电子式中,溴离子需要标出所带电荷及最外层电子;
B.硫离子的核电荷数=核外电子总数=16,最外层为6个电子;
C.次氯酸分子中不存在氢氯键,其分子中存在1个氧氢键和1个氢氯键;
D.质量数=质子数+中子数,元素符号的左上角为质量数,左下角为质子数.
解答 解:A.溴离子为阴离子,需要标出最外层电子和所带电荷,溴化铵正确的电子式应为: ,故A错误;
,故A错误;
B.硫原子的最外层为6个电子,硫原子正确的结构示意图应为: ,故B错误;
,故B错误;
C.次氯酸的中心原子为O原子,次氯酸正确的电子式应为: ,故C错误;
,故C错误;
D.氯为17号元素,质子数为17,中子数为18,则质量数为35,该原子可以表示为:1735Cl,故D正确;
故选D.
点评 本题考查了化学用语的表示方法判断,题目难度中等,涉及原子结构示意图、电子式、元素符号等知识,注意掌握常见化学用语的书写原则,C为易错点,注意次氯酸的中心原子为O.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.将4mol A和2mol B放入2L密闭容器中发生反应:2A(g)+B(g)?2C(g)△H<0,4s后反应达到平衡状态,此时测得C的浓度为0.6mol/L.下列说法正确的是( )
| A. | 4 s内,v(B)=0.075 mol/(L•s) | |
| B. | 4 s后平衡状态下,c(A):c(C)=2:1 | |
| C. | 达到平衡状态时,若只升高温度,则C的物质的量浓度增大 | |
| D. | 达到平衡状态后,若温度不变,缩小容器的体积,则A的转化率降低 |
15.如表实验“操作和现象”与“结论”对应关系不相符的是( )
| 选项 | 操作和现象 | 结论 |
| A | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在试管口观察到红棕色气体 | 发生反应先生成NO,进而与O2反应生成NO2 |
| B | 取皂化反应的混合液滴入盛水的烧杯中,出现油滴 | 皂化反应完全 |
| C | 在溴乙烷中加入NaOH的乙醇溶液并加热,将产生的气体依次通过水、酸性KMnO4溶液,KMnO4溶液紫红色褪色 | 使KMnO4溶液褪色的气体是乙烯 |
| D | 向漂白粉溶液中通入过量的二氧化硫,溶液变浑浊 | 析出了硫酸钙 |
| A. | A | B. | B | C. | C | D. | D |
2.用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,11.2LO2参加反应转移的电子数一定为2NA | |
| B. | 用双氧水分解制取0.1mol氧气,转移的电子总数为0.4×6.02×1023 | |
| C. | 0.1molAlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 | |
| D. | 28gN2和CO的混合气体中含有的分子数为NA |
12.下列物质不是从海水中提取的是( )
| A. | 铝 | B. | 镁 | C. | 液溴 | D. | 重水 |
17.下列说法正确的是( )
| A. | 中和等体积、等物质的量浓度盐酸和醋酸溶液,盐酸所需NaOH溶液多于醋酸 | |
| B. | 常温下,20 LpH=12的Na2CO3溶液中含有的OH-离子数为0.2NA | |
| C. | 向0.1 mol/LCH3COOH溶液中加入少量CH3COONa固 体,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ 增大 | |
| D. | 一定温度下,10mL 0.50mol•L-1NH4Cl溶液与20mL 0.25mol•L-1NH4C1溶液含NH4+物质的量相同 |
 阿斯巴甜(APM)是一种甜度高、味美而热量低的甜味剂,其结构简式如图所示.
阿斯巴甜(APM)是一种甜度高、味美而热量低的甜味剂,其结构简式如图所示.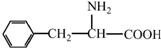 是合成APM的原料之一.苯丙氨酸的一种合成途径如图所示:
是合成APM的原料之一.苯丙氨酸的一种合成途径如图所示:
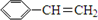 .
.
 .
.