��Ŀ����
4�������軯�أ�K4Fe��CN��6����Ѫ�Σ���ʵ���ҡ���ơ�ʳƷ���Ӽ���ҽѧ�Ͽ�����ұ���裨Tl���ж����������ʱ�����ڻ滭���й㷺��;��һ���ú�NaCN��ˮ�ϳɻ�Ѫ�ε���Ҫ�����������£�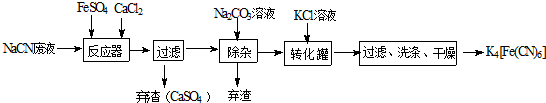
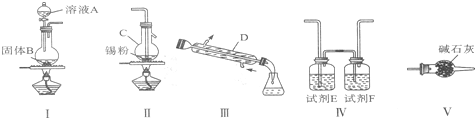
��1��ʵ������NaCN��������NaCN��Һʱ��Ӧ�Ƚ�������NaOH��Һ����������ˮϡ�ͣ�
��2��ʵ����K4Fe��CN��6�����ڼ���Fe3+�����ɵ�������KFe[Fe��CN��6]�����ɵ����ֿ���������Tl2SO4�ж�����д��������Ӧ�����ӷ���ʽΪK++[Fe��CN��6]4-+Fe3+=KFe[Fe��CN��6]����KFe[Fe��CN��6]��s��+Tl+��aq��=TlFe[Fe��CN��6]��s��+K+��aq����
��3������ͼ�м���̼������Һ��ҪĿ���dz�ȥ���е�Ca2+��
��4����ͬ�¶����ܽ�ȣ�Na4[Fe��CN��6]��K4[Fe��CN��6]��ѡ�����������=��������������
��5�����ڻ������������軯�ص�ʳ�Σ���ʱ�ᷢ���ֽⷴӦ������ƽ���з���ʽ��
3K4Fe��CN��6=��KCN+��Fe3C+��C+����CN��2��+��N2��
��6�������ʱ�����Һ����ֱ������������Һ���ɽ���ת��ΪK4[Ag2��CN��6]��д��2AgCl���Ѫ����ȡ���Һ�����ӷ���ʽ2AgCl+[Fe��CN��6]4-=Fe2++[Ag2��CN��6]4-+2Cl-��
��7����Ѫ������������Һ��Ӧ���䷽��ʽΪ��K4Fe��CN��6+KMnO4+H2SO4�TKHSO4+Fe2��SO4��3+MnSO4+HNO3+CO2��+H2O��δ��ƽ����1mol K4Fe��CN��6������������������ĸ�����ص����ʵ���Ϊ12.2mol��
���� ��ʵ��Ŀ���Ǻϳɻ�Ѫ�Σ������̿�֪��NaCN��Һ�м��������������Ȼ��ƣ�����6NaCN+FeSO4+CaCl2=Na4[Fe��CN��6+CaSO4��+2NaCl��Ȼ�����̼������Һ�ɳ�ȥ������Ca2+�������˺�����Һ�м���KCl��ת������K4[Fe��CN��6��˵��K4[Fe��CN��6�ܽ�Ƚ�С���Դ˽����⣮
��1��NaCNΪǿ�������Σ���Һ��CN-����ˮ����Һ�ʼ��ԣ���������Һʱ����ˮ�⣬�ݴ˴��⣻
��2��NaCN��Һ�м��������������Ȼ��ƣ�����6NaCN+FeSO4+CaCl2=Na4[Fe��CN��6+CaSO4��+2NaCl��
��3����Ӧ���м����Ȼ��ƣ���Ҫ����̼���Ƴ�ȥ��
��4�������˺�����Һ�м���KCl��ת������K4[Fe��CN��6��˵��K4[Fe��CN��6�ܽ�Ƚ�С��
��5������ԭ���غ�͵����غ���ƽ��д��ѧ����ʽ��
��6��AgCl���Ѫ����ȡ���Һ�ɽ���ת��ΪK4[Ag2 ��CN��6]����ϵ绰�غ㣬ԭ���غ�����д��
��7������������ԭ��Ӧԭ�������õ��ӵ�ʧ�غ���������ص����ʵ�����
��� �⣺ʵ��Ŀ���Ǻϳɻ�Ѫ�Σ������̿�֪��NaCN��Һ�м��������������Ȼ��ƣ�����6NaCN+FeSO4+CaCl2=Na4[Fe��CN��6+CaSO4��+2NaCl��Ȼ�����̼������Һ�ɳ�ȥ������Ca2+�������˺�����Һ�м���KCl��ת������K4[Fe��CN��6��˵��K4[Fe��CN��6�ܽ�Ƚ�С��
��1��NaCNΪǿ�������Σ���Һ��CN-����ˮ����Һ�ʼ��ԣ�NaCNˮ��ʼ��Ե����ӷ���ʽΪ��CN-+H2O?HCN+OH-��Ϊ����ˮ�⣬��������Һʱ�ɽ����ܽ�������������Һ�У��ڼ�ˮϡ�ͣ�
�ʴ�Ϊ��NaOH��
��2��NaCN��Һ�м��������������Ȼ��ƣ�����6NaCN+FeSO4+CaCl2=Na4[Fe��CN��6+CaSO4��+2NaCl�����Լ���Fe3+�����ӷ���ʽΪ��K++[Fe��CN��6]4-+Fe3+=KFe[Fe��CN��6]��������Tl2SO4�ж��ķ���ʽΪKFe[Fe��CN��6]��s��+Tl+��aq��=TlFe[Fe��CN��6]��s��+K+��aq����
�ʴ�Ϊ��K++[Fe��CN��6]4-+Fe3+=KFe[Fe��CN��6]����KFe[Fe��CN��6]��s��+Tl+��aq��=TlFe[Fe��CN��6]��s��+K+��aq����
��3����Ӧ���м����Ȼ��ƣ�����̼������Һ�ɳ�ȥ������Ca2+��
�ʴ�Ϊ����ȥ���е�Ca2+��
��4�������˺�����Һ�м���KCl��ת������K4[Fe��CN��6��˵��K4[Fe��CN��6�ܽ�Ƚ�С��
�ʴ�Ϊ������
��5������K4Fe��CN��6��ϵ��Ϊ3�����ԭ���غ㣬Fe3Cǰϵ��Ϊ3��KCNǰϵ��Ϊ12�������غ�õ�N2ǰϵ��Ϊ1�����ݵ�ԭ���غ㣬��CN��2ǰϵ��Ϊ2��̼ԭ���غ㣬Cǰϵ��Ϊ1����ƽ�õ��Ļ�ѧ����ʽΪ��3K4Fe��CN��6=Fe3C+12KCN+N2��+C+2��CN��2����
�ʴ�Ϊ��12��1��1��2��1��
��6�����Һ����ֱ������������Һ���ɽ���ת��ΪK4[Ag2 ��CN��6]��AgCl���Ѫ����ȡ���Һ�ɽ���ת��ΪK4[Ag2 ��CN��6]����Ӧ�����ӷ���ʽΪ��2AgCl+[Fe��CN��6]4-=Fe2++[Ag2 ��CN��6]4-+2Cl-��
�ʴ�Ϊ��2AgCl+[Fe��CN��6]4-=Fe2++[Ag2 ��CN��6]4-+2Cl-��
��7��1mol K4Fe��CN��6�������������ʱ��Fe���ϼ���+2�����ߵ�+3�ۣ�NԪ�ػ��ϼ���-3�����ߵ�+5�ۣ�CԪ�ػ��ϼ���+2�����ߵ�+4�ۣ���Fe��N��C�Ļ��ϼ�������1+6����8+2��=61�ۣ���ʧȥ61mol���ӣ�����������е���Ԫ�ش�+7��Ϊ+2�ۣ���õ�5mol���ӣ����ݵ����غ㣬1mol K4Fe��CN��6��������������������ĸ�����ص����ʵ���Ϊ12.2mool��
�ʴ�Ϊ��12.2��
���� ���⿼�����ʵ��Ʊ�ʵ�鷽������ƣ�������ѧ���ķ���������ʵ�������ͼ��������Ŀ��飬Ϊ�߿��������ͣ�ע���������ͼ����ʵ���ԭ���Ͳ����������Ѷ��еȣ�ע�����������ԭ��Ӧ�Ļ��ϼ۵�����������ȼ��㣮

| �� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
| �� | �� | �� | ||||||
| �� | �� | �� | �� | �� | �� | �� | �� | |
| �� | �� | ⑪ | ⑫ |
��2������ЩԪ���У�����õĽ���Ԫ����K����Ԫ�ط��ţ���ͬ��������õķǽ���Ԫ����F��
��3������ЩԪ�ص�����������Ӧˮ�����У�������ǿ����HClO4����д��ѧʽ����ͬ����������ǿ����KOH�������Ե�����������Al��OH��3��д����������������������ǿ�Ӧ�Ļ�ѧ����ʽ��Al��OH��3+KOH=KAlO2+2H2O��
��4���ڢ�����У���ѧ���ʽϻ��õ���Na����Ԫ�ط��ţ�������֤��������д��һ��ʵ����ʵ���ɣ�
Na����ˮ���ҷ�Ӧ��Mg����ˮ����������Ӧ��
| A�� | 0.15mol/��L•min�� | B�� | 0.3mol/��L•min�� | C�� | 0.45mol/��L•min�� | D�� | 0.6mol/��L•min�� |
| A�� | ϡH2SO4 | B�� | ����������Һ | C�� | ����ͭ��Һ | D�� | �Ȼ�����Һ |
| ʵ����ʵ | ���ۻ���� | |
| A | ��ij��Һ�еμ���ˮ�����Ȼ�̼�����ú�ֲ㣬���Ȼ�̼���Ϻ�ɫ | ˵��ԭ��Һ�к���I- |
| B | ��SO2��ˮ��Һ�еμ����ᱵ��Һ�а�ɫ���� | ���ɵij���ΪBaSO3 |
| C | ��FeSO4��Һ�еμ����Ը��������Һ�����������Һ��ɫ | Fe2+���л�ԭ�� |
| D | 25�������ᱵ������Һ�м��������������ƹ��壬�����ᱵ�������� | ����c��SO42-����Ksp��BaSO4����С |
| A�� | A�� | B�� | B�� | C�� | C�� | D�� | D�� |

��֪�÷�Ӧ����صĻ�ѧ�������������£�
| ��ѧ�� | H-H | C-O | H-O | C-H |
| E/��kJ•mol-1�� | 436 | 343 | 465 | 413 |