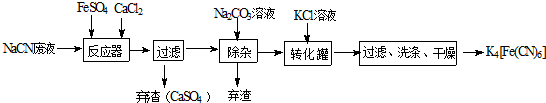
题目内容
17.下列说法不正确的是( )①将CO2通入溶有足量氨的BaCl2溶液中,无白色沉淀生成
②将盐酸、KSCN溶液和Fe(NO3)2溶液三种溶液混合,混合溶液显红色
③向某溶液中滴入盐酸酸化的BaCl2溶液产生白色沉淀,证明溶液中一定含有SO42-
④将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺些小孔,然后投入水中,两者放出的氢气质量相等
⑤将SO2通入溴水中,证明SO2具有漂白性
⑥在滴有酚酞的Na2CO3溶液中,加入BaC12溶液后红色逐渐褪去,证明Na2CO3溶液中存在水解平衡
⑦因为CO2的相对分子质量比SiO2的小,所以CO2的熔沸点比SiO2的熔沸点低
⑧某溶液中加入稀盐酸,生成的无色无味的气体可以使澄清石灰水变浑浊,不能证明原溶液中一定含CO32- 离子.
| A. | ②④⑥⑦ | B. | ①②③⑥ | C. | ①③④⑤⑦ | D. | ③④⑤⑦⑧ |
分析 ①将CO2通入溶有足量氨的BaCl2溶液中,反应生成碳酸钡和氯化铵;
②将盐酸、KSCN溶液和Fe(NO3)2溶液三种溶液混合,亚铁离子、氢离子、硝酸根离子发生氧化还原反应生成铁离子;
③向某溶液中滴入盐酸酸化的BaCl2溶液产生白色沉淀,白色沉淀可能为AgCl或硫酸钡;
④将两小块质量相等的金属钠,Na与水反应生成NaOH和氢气,且Al能与NaOH溶液反应生成氢气;
⑤将SO2通入溴水中,发生氧化还原反应生成硫酸和HBr;
⑥在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液反应生成碳酸钡沉淀,碳酸根离子水解平衡逆向移动,氢氧根离子浓度减小;
⑦晶体类型不同,SiO2为原子晶体,熔沸点高;
⑧某溶液中加入稀盐酸,生成的无色无味的气体可以使澄清石灰水变浑浊,气体为二氧化碳,原溶液中可能含CO32-离子或HCO3-.
解答 解:①将CO2通入溶有足量氨的BaCl2溶液中,反应生成碳酸钡和氯化铵,生成生成白色沉淀,故错误;
②将盐酸、KSCN溶液和Fe(NO3)2溶液三种溶液混合,亚铁离子、氢离子、硝酸根离子发生氧化还原反应生成铁离子,遇KSCN则混合溶液显红色,故正确;
③向某溶液中滴入盐酸酸化的BaCl2溶液产生白色沉淀,白色沉淀可能为AgCl或硫酸钡,则不能证明溶液中含有SO42-,故错误;
④将两小块质量相等的金属钠,Na与水反应生成NaOH和氢气,且Al能与NaOH溶液反应生成氢气,则用铝箔包住的钠与水反应生成氢气多,故错误;
⑤将SO2通入溴水中,发生氧化还原反应生成硫酸和HBr,体现二氧化硫的还原性,故错误;
⑥在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液反应生成碳酸钡沉淀,碳酸根离子水解平衡逆向移动,氢氧根离子浓度减小,则红色逐渐褪去,证明Na2CO3溶液中存在水解平衡,故正确;
⑦晶体类型不同,SiO2为原子晶体,熔沸点高,而二氧化碳为分子晶体,分子晶体的沸点较低,故错误;
⑧某溶液中加入稀盐酸,生成的无色无味的气体可以使澄清石灰水变浑浊,气体为二氧化碳,原溶液中可能含CO32-离子或HCO3-,故正确;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应原理、离子检验及晶体类型等为解答的关键,侧重分析与实验能力的考查,综合性较强,题目难度不大.

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案| A. | 0.1 mol/L | B. | 0.2 mol/L | C. | 0.3 mol/L | D. | 0.4 mol/L |
| A. | 常温下,0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合,测得混合溶液pH=8,则混合溶液中水电离产生的c(OH-)=1×10-8 | |
| B. | 室温下,CH3COONa和CaCl2的混合溶液:c (Na+)+c(Ca2+)=c (CH3COO-)+c(CH3COOH)+c(Cl-) | |
| C. | 恒容密闭容器中进行反应2A2(g)+B2(g)?2A2B(g)△H<0,达到化学平衡后,加热会使逆反应速率大于正反应速率 | |
| D. | 常温下,pH=11的氨水和pH=1的盐酸等体积混合,恰好完全反应,则混合溶液中c(NH4+)+c(NH3?H2O)+c(NH3)=5×10-4mol/L |
①晶体的溶解; ②盐溶液的电解;③盐的水解; ④电解质的电离;⑤乙酸乙酯的生成; ⑥Fe(OH)3溶液与硅酸溶胶混合;⑦蛋白质溶液中加入饱和的硫酸铵溶液;⑧蛋白质溶液中加入福尔马林;⑨合成氨.
| A. | ①②③④⑦⑨ | B. | ②⑤⑥⑧ | C. | ⑤⑥⑦⑧ | D. | ②⑥⑧ |
| A. | X、Y相对分子质量之差为84 | |
| B. | X中含有HCOO-,Y中含有-OH | |
| C. | Y的分子式为:C7H8O3 | |
| D. | 若X中有四种氢,则满足条件的X可能有两种 |
| A. | NaCl | B. | Na2CO3 | C. | NH4Cl | D. | NaHSO4 |
 .
. 某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,图为反应产生氢气速率与反应时间的关系图.
某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,图为反应产生氢气速率与反应时间的关系图.