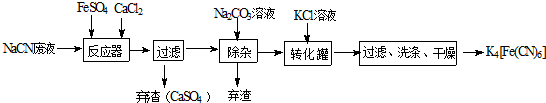
题目内容
15.将A和B的混合物15mol放入容积为2L的密闭容器转化,在一定条件下发生反应,2A(g)+3B(g)═C(g)+2D(g).当反应进行了15min时,容器内气体的压强是反应前的0.8倍,则15min内物质B的平均反应速率为( )| A. | 0.15mol/(L•min) | B. | 0.3mol/(L•min) | C. | 0.45mol/(L•min) | D. | 0.6mol/(L•min) |
分析 当反应进行了15min时,容器内气体的压强是反应前的0.8倍,则反应后气体的总物质的量为15mol×0.8=12mol,
2A(g)+3B(g)═C(g)+2D(g)△n
3 2
x (15mol-12mol)
$\frac{3}{x}$=$\frac{2}{(15mol-12mol)}$,解得x=4.5mol,
结合v=$\frac{△c}{△t}$计算.
解答 解:当反应进行了15min时,容器内气体的压强是反应前的0.8倍,则反应后气体的总物质的量为15mol×0.8=12mol,
设参加反应的B的物质的量为x,
2A(g)+3B(g)═C(g)+2D(g)△n
3 2
x (15mol-12mol)
$\frac{3}{x}$=$\frac{2}{(15mol-12mol)}$,解得x=4.5mol,
v(B)=$\frac{\frac{4.5mol}{2L}}{15min}$=0.15mol/(L.min),
故选A.
点评 本题考查化学平衡的计算及反应速率的计算,为高频考点,把握物质的量与压强的关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
5.下列变化肯定不可逆的组是( )
①晶体的溶解; ②盐溶液的电解;③盐的水解; ④电解质的电离;⑤乙酸乙酯的生成; ⑥Fe(OH)3溶液与硅酸溶胶混合;⑦蛋白质溶液中加入饱和的硫酸铵溶液;⑧蛋白质溶液中加入福尔马林;⑨合成氨.
①晶体的溶解; ②盐溶液的电解;③盐的水解; ④电解质的电离;⑤乙酸乙酯的生成; ⑥Fe(OH)3溶液与硅酸溶胶混合;⑦蛋白质溶液中加入饱和的硫酸铵溶液;⑧蛋白质溶液中加入福尔马林;⑨合成氨.
| A. | ①②③④⑦⑨ | B. | ②⑤⑥⑧ | C. | ⑤⑥⑦⑧ | D. | ②⑥⑧ |
3.下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填元素符号).元素⑩名称为溴,在周期表中的位置第四周期VIIA族.
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是 .
.
(3)用电子式表示元素④与⑥的化合物的形成过程: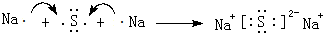 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.
(4)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是S 2->Cl->O2-(用离子符号表示).
(5)元素③的氢化物的结构式为H-O-H;该氢化物常温下和元素⑦的单质反应的化学方程式为Cl2+H2O=HCl+HClO.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是
 .
.(3)用电子式表示元素④与⑥的化合物的形成过程:
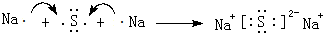 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.(4)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是S 2->Cl->O2-(用离子符号表示).
(5)元素③的氢化物的结构式为H-O-H;该氢化物常温下和元素⑦的单质反应的化学方程式为Cl2+H2O=HCl+HClO.
20.为了除去下列物质中所含有的杂质(括号内),将所加的试剂和分离的方法填入表格.
| 混合物 | 试剂 | 分离方法 | |
| ① | 溴苯(Br2) | NaOH溶液 | 分液 |
| ② | 甲烷(乙烯) | 溴水 | 洗气 |
| ③ | 乙炔(H2S) | 硫酸铜溶液 | 洗气 |
| ④ | 乙烯(SO2) | NaOH溶液 | 洗气 |
| ⑤ | CO2(HCl) | 饱和碳酸氢钠溶液 | 洗气 |
1.下列说法正确的是( )
| A. | 医用酒精是指质量分数为75%的乙醇溶液 | |
| B. | 用过滤的方法可以分离乙醇和乙酸乙酯 | |
| C. | 肥皂能去污的原理,是其在水溶液中能电离出钠离子(亲水基团)和硬脂酸根离子(亲油基团),在它们的共同作用下,通过搓洗,将衣服上的油污“拖下水” | |
| D. | 葡萄糖、氨基酸在一定条件下都能发生酯化反应 |
 某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,图为反应产生氢气速率与反应时间的关系图.
某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,图为反应产生氢气速率与反应时间的关系图.