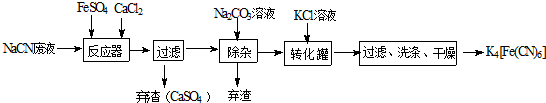
题目内容
18.下表是元素周期表的一部分,回答下列有关问题:| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 四 | ⑩ | ⑪ | ⑫ |
(2)在这些元素中,最活泼的金属元素是K(填元素符号,下同),最活泼的非金属元素是F.
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4(填写化学式,下同),碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3,写出这种两性氢氧化物与最强碱反应的化学方程式:Al(OH)3+KOH=KAlO2+2H2O;
(4)在③与④中,化学性质较活泼的是Na(填元素符号),怎样证明?(任写出一种实验事实即可)
Na与冷水剧烈反应,Mg与冷水发生缓慢反应.
分析 (1)由元素在周期表中位置,可知①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为S、⑧为Cl、⑨为Ar、⑩为K、⑪为Ca、⑫为Br;
(2)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱;
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是高氯酸,K的金属性最强,故氢氧化钾的碱性最强,氢氧化铝属于两性氢氧化物;
(4)同周期自左而右金属性减弱,可以利用金属与水反应的剧烈程度证明.
解答 解:(1)由元素在周期表中位置,可知①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为S、⑧为Cl、⑨为Ar、⑩为K、⑪为Ca、⑫为Br,故答案为:N;Si;S;Ca;
(2)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,故上述元素中K的金属性最强,F的非金属性最强,故答案为:K;F;
(3)最高价氧化物对应水化物中,酸性最强的是HClO4,上述元素中K的金属性最强,故KOH的碱性最强,Al(OH)3属于两性氢氧化物,与KOH反应方程式为:Al(OH)3+KOH=KAlO2+2H2O,
故答案为:HClO4;KOH;Al(OH)3;Al(OH)3+KOH=KAlO2+2H2O;
(4)同周期自左而右金属性减弱,故金属性Na>Mg,可以利用金属与水反应的剧烈程度证明,Na与冷水剧烈反应,Mg与冷水发生缓慢反应,
故答案为:Na;Na与冷水剧烈反应,Mg与冷水发生缓慢反应.
点评 本题考查元素周期表与元素周期律,侧重对元素周期律的考查,注意理解掌握金属性、非金属性强弱比较及实验事实.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列说法正确的是( )
| A. | 常温下,0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合,测得混合溶液pH=8,则混合溶液中水电离产生的c(OH-)=1×10-8 | |
| B. | 室温下,CH3COONa和CaCl2的混合溶液:c (Na+)+c(Ca2+)=c (CH3COO-)+c(CH3COOH)+c(Cl-) | |
| C. | 恒容密闭容器中进行反应2A2(g)+B2(g)?2A2B(g)△H<0,达到化学平衡后,加热会使逆反应速率大于正反应速率 | |
| D. | 常温下,pH=11的氨水和pH=1的盐酸等体积混合,恰好完全反应,则混合溶液中c(NH4+)+c(NH3?H2O)+c(NH3)=5×10-4mol/L |
9.在水中加入下列物质,可使水的电离平衡正向移动的是( )
| A. | NaCl | B. | Na2CO3 | C. | NH4Cl | D. | NaHSO4 |
3.下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填元素符号).元素⑩名称为溴,在周期表中的位置第四周期VIIA族.
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是 .
.
(3)用电子式表示元素④与⑥的化合物的形成过程: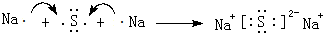 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.
(4)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是S 2->Cl->O2-(用离子符号表示).
(5)元素③的氢化物的结构式为H-O-H;该氢化物常温下和元素⑦的单质反应的化学方程式为Cl2+H2O=HCl+HClO.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是
 .
.(3)用电子式表示元素④与⑥的化合物的形成过程:
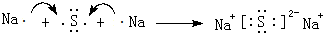 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.(4)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是S 2->Cl->O2-(用离子符号表示).
(5)元素③的氢化物的结构式为H-O-H;该氢化物常温下和元素⑦的单质反应的化学方程式为Cl2+H2O=HCl+HClO.
5.如图是日常生活中电动自行车的主要部件铅蓄电池结构示意图.有关说法不正确的是( )
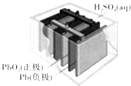

| A. | 铅蓄电池属于二次电池 | |
| B. | 实际使用过程中可以无限次充放电 | |
| C. | 使用过程中负极发生氧化反应 | |
| D. | 铅蓄电池体积大有污染还不是最理想的电池 |
 某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,图为反应产生氢气速率与反应时间的关系图.
某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,图为反应产生氢气速率与反应时间的关系图.