题目内容
【题目】室温下,使用pH计测定0.1mol/LNH4Cl溶液的pH=5.12(如图)由此可以得到的结论是___(填字母)。

a.NH3·H2O是弱碱
b.溶液中c(H+)>c(OH-)
c.NH4+水解是吸热反应
d.由H2O电离出的c(H+)<10-7mol/L
e.物质的量浓度相等的氨水和盐酸等体积混合,溶液pH=7
(2)室温下,用0.10mol/LNaOH溶液分别滴定20.00mL0.10mol/L的盐酸和醋酸,滴定曲线如图所示
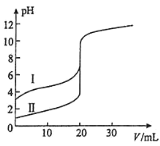
①表示滴定盐酸的曲线是_____(填序号)。
②若此实验选用酚酞为指示剂,则滴定到达终点的现象是_____。
③若用标准NaOH溶液测定未知盐酸溶液的浓度,下列实验操作会使实验结果偏低的是_____。
a.锥形瓶用待测液润洗后再注入待测液
b.碱式滴定管滴定前有气泡,滴定后无气泡
c.碱式滴定管滴定前仰视读数,滴定后平视读数
②在滴定醋酸溶液的过程中:V(NaOH)=10.00mL时,溶液中离子浓度由大到小的顺序为____________。当c(Na+)=c(CH3COO-)+c(CH3COOH)时,溶液pH________7(填“>”、“=”或“<”)。
【答案】ab Ⅱ 溶液由无色变为(浅)红色,且半分钟不变色 c c(CH3COO-)>c(Na+)>c(H+)>c(OH-) >
【解析】
(1)a.pH=5.12,正盐水溶液呈酸性,阳离子发生了水解,NH3·H2O是弱碱,a正确;
b.室温下溶液pH=5.12,溶液呈酸性,b正确;
c.实验中没有做有关热量变化的实验,无从得知NH4+水解是吸热反应,c不正确;
d.氯化铵促进了水的电离,所以由水电离出的c(H+)=10-5.12>10-7mol/L,d不正确;
e.物质的量浓度相等的氨水和盐酸等体积混合,生成的NH4Cl为强酸弱碱盐,水溶液显酸性,pH<7,e不正确;
答案为:ab;
(2)①盐酸为强酸,0.10mol/L的盐酸初始pH=1,由此确定对应的滴定曲线为Ⅱ;
起初锥形瓶中加酸,溶液呈无色,后来碱稍过量,溶液呈浅红色,滴定达终点时的现象为溶液由无色变为(浅)红色,且半分钟不变色;
a.锥形瓶用待测液润洗后再注入待测液,会使得酸的物质的量偏多,从而导致消耗NaOH的量增大,结果偏高,a不合题意;
b.碱式滴定管滴定前有气泡,滴定后无气泡,有一部分碱液填充了原来气泡的空间,耗碱量偏大,使得结果偏高,b不合题意;
c.滴定管刻度上小下大,滴定前仰视读数,使得读数偏大,滴定后平视读数,读数准确,差值偏小,结果偏小,c符合题意;
答案为:c;
②V(NaOH)=10.00mL时,在不考虑电离和水解的时候,溶质组成为1:1的CH3COONa和CH3COOH,图中可见pH<7,即c(H+)>c(OH-),醋酸电离程度大于醋酸根水解程度,所以c(CH3COO-)>c(Na+),又因为c(H+)和c(OH-)比c(CH3COO-)和c(Na+)小几个数量级,由此可得出离子浓度大小关系为c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。当c(Na+)=c(CH3COO—)+c(CH3COOH)时,NaOH加入20mL,恰好中和,此时溶质全是CH3COONa,强碱弱酸盐水溶液显碱性,所以pH>7。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案【题目】(15分)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为____________。
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中![]() 为:_____________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
为:_____________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)已知反应2HI(g) ===H2(g) + I2(g)的ΔH= +11kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为______________kJ。
(4)Bodensteins研究了下列反应:2HI(g)![]() H2(g) + I2(g)
H2(g) + I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:___________。
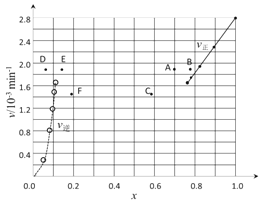
②上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为________(以K和k正表示)。若k正 = 0.0027min-1,在t=40min时,v正=________min-1
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2/span>)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为_________________(填字母)