题目内容
【题目】甲醛(HCHO)俗称蚁醛,是一种重要的有机原料。
I.利用甲醇(CH3OH)制备甲醛
脱氢法:CH3OH(g)=HCHO(g)+H2(g) △H1 = +92.09kJ/mol
氧化法:CH3OH(g) +1/2O2(g)=HCHO(g)+H2O(g) △H2
(1)已知:2H2(g)+O2(g)=2H2O(g) △H3=-483.64 kJ/mol,则△H2=_______。
(2)与脱氢法相比,氧化法在热力学上趋势较大,其原因为_______________。
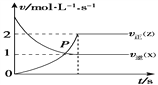
(3)图1为甲醇制备甲醛反应的lg K(K为平衡常数)随温度(T)的变化曲线。曲线____(填“a”或“b”)对应脱氢法,判断依据为_________________。

II.甲醛的用途
(4)将甲醛水溶液与氨水混合蒸发可制得乌洛托品(结构简式如图2),该物质在医药等工业中有广泛用途。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为_______。
(5)将甲醛水溶液与硫酸镍(NiSO4)混合,可用于化学镀镍。若反应过程中有CO2产生,则该反应的离子方程式为____________________。
Ⅲ.甲醛的检测
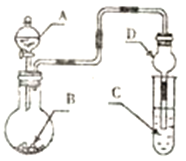
(6)室内甲醛超标会危害人体健康,通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图3所示,则b极的电极反应式为_________,当电路中转移4×10-4 mol电子时,传感器内参加反应的HCHO为_______mg。
【答案】 -149.73kJ/mol 脱氢法的反应为吸热反应,氧化法的反应为放热反应,放热反应在热力学上趋势较大。 b 脱氢、吸热 3:2 2Ni2++HCHO+H2O=2Ni+CO2↑+4H+ O2+4e-+4H+=2H2O 3
【解析】(1)根据盖斯定律,-4△H1+2△H2=△H3,则有△H2=(△H3+4△H1)/2=-149.73kJ/mol。
故答案为:-149.73kJ/mol;
(2)脱氢法的反应为吸热反应,氧化法的反应为放热反应,放热反应在热力学上趋势较大。
故答案为:脱氢法的反应为吸热反应,氧化法的反应为放热反应,放热反应在热力学上趋势较大。
(3)脱氢法的反应为吸热反应,随着温度升高,平衡向右移动,平衡常数增大,故曲线b对应脱氢法。
故答案为:b;脱氢吸热;
(4)每个乌洛托品分子中含有6个C原子,4个N原子,根据原子守恒可知,要形成1个乌洛托品分子,需要6个甲醛分子、4个氨气分子,则需要甲醛和氨气的分子个数之比为6∶4,即3∶2。分子数之比等于物质的量之比,所以甲醛与氨的物质的量之比为3∶2。
故答案为:3∶2;
(5)将甲醛水溶液与硫酸镍(NiSO4)混合,可用于化学镀镍,则甲醛与硫酸镍发生氧化还原反应,析出Ni单质,甲醛被氧化为CO2,Ni元素化合价由+2价降低到0价,甲醛中C元素由0价升高到+4价,NiSO4与HCHO的系数比为2∶1,根据化合价升降守恒配平得离子方程式为:2Ni2++HCHO+H2O=2Ni+CO2↑+4H+;
故答案为:2Ni2++HCHO+H2O=2Ni+CO2↑+4H+;
(6)HCHO转化为CO2,C元素由0价升高到+4价,失去电子,被氧化,所以a为电池负极,b为正极。酸性环境下,O2作正极的电极反应为O2+4e-+4H+=2H2O;负极的电极反应为HCHO-4e-+H2O = CO2↑+4H+,每反应1molHCHO转移4mol电子,当电路中转移4×10-4mol电子时,参见反应的HCHO为1×10-4mol,质量=30g/mol×1×10-4mol=3×10-3g=3mg。故答案为:O2+4e-+4H+=2H2O;3。
故答案为:O2+4e-+4H+=2H2O;3。