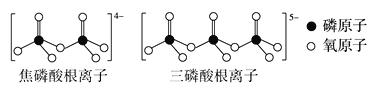
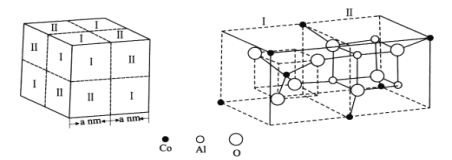
题目内容
【题目】(1)从绿色化学、环保的角度选择制取硫酸铜的原料________。
a.Cu b.CuO
c.CuS d.Cu(OH)2·CuSO4
(2)写出从硫酸铜溶液中得到硫酸铜晶体的操作:________、________、过滤、洗涤……
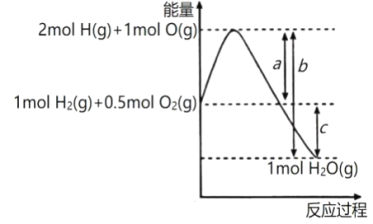
(3)如图球形管装置的作用:_________________________________________。
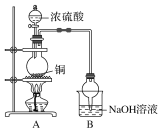
(4)反应后溶液中存在Cu2+,但浓硫酸有吸水性,不能通过溶液颜色来判断Cu2+的存在,请写出一种简便的方法验证Cu2+的存在:_________________________________________________________________。
(5)在实际反应中,由于条件控制不好,容易产生CuS和Cu2S固体。
已知:2CuS![]() Cu2S+S。取a g固体样品(只含CuS和Cu2S),加热后测得Cu2S固体质量为b g,求固体样品中CuS质量分数________:若Cu2S在高温下会分解为Cu,则测得CuS的质量分数________(偏大、偏小或不变)。
Cu2S+S。取a g固体样品(只含CuS和Cu2S),加热后测得Cu2S固体质量为b g,求固体样品中CuS质量分数________:若Cu2S在高温下会分解为Cu,则测得CuS的质量分数________(偏大、偏小或不变)。
(6)根据以上信息,说明Cu与浓硫酸反应需要控制哪些因素:________________________________。
【答案】bd 蒸发浓缩 冷却结晶 防止倒吸 将反应溶液小心沿烧杯内壁倒入水中,若溶液变蓝,则说明反应产生了Cu2+ 100%×![]() 或[
或[![]() ]% 偏大 控制温度不宜过高,反应时间不宜过长
]% 偏大 控制温度不宜过高,反应时间不宜过长
【解析】
(1)从绿色化学、环保的角度分析是否有有害物质生成或参与;
(2)硫酸铜的溶解度随温度降低而下降,从硫酸铜溶液中得到硫酸铜晶体用降温结晶的方法能得到更多的晶体;
(3)球形管提供较大的空间,防止形成过大的负压,可以起到防倒吸的作用;
(4)由于浓硫酸的吸水性,导致Cu2+无法与水结合产生蓝色溶液;
(5)依据题给数据列方程组求解可得;若Cu2S在高温下分解为Cu,则测得加热后得到的固体质量b就会偏小;
(6)由题意可知,若反应温度过高,反应时间过长,容易产生CuS和Cu2S固体。
(1)a、Cu与浓硫酸加热反应才能制取硫酸铜,并且产生污染环境的气体二氧化硫,故错误;
b、CuO与稀硫酸反应即可生成硫酸铜,且无污染环境的产物,故正确;
c、CuS不溶于酸,如果要制备硫酸铜,需要先与氧气反应生成氧化铜和二氧化硫,氧化铜再与稀硫酸反应得到硫酸铜,过程中产生二氧化硫污染环境,故错误;
d、Cu(OH)2·CuSO4只需要稀硫酸并无有害产物;
bd正确,故答案为:bd;
(2)硫酸铜的溶解度随温度降低而下降,用降温结晶的方法得到更多的晶体,则从硫酸铜溶液中得到硫酸铜晶体的操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故答案为:蒸发浓缩;冷却结晶;
(3)球形管提供较大的空间,防止形成过大的负压,可以起到防倒吸的作用,故答案为:防止倒吸;
(4)由于浓硫酸的吸水性,导致Cu2+无法与水结合产生蓝色溶液,因此需要加水稀释检验铜离子,需要注意的是原反应液中存在浓硫酸,因此稀释时应注酸入水,即原反应液倒入水中进行稀释,若溶液呈蓝色,则说明铜离子的存在,故答案为:将反应溶液小心沿烧杯内壁倒入水中,若溶液变蓝,则说明反应产生了Cu2+;
(5)设CuS质量为x g,Cu2S质量为y g,根据题意可列出方程x+y=a,y+![]() x=b,解得x=6(a-b),因此CuS的质量分数为
x=b,解得x=6(a-b),因此CuS的质量分数为![]() ×100%或[
×100%或[![]() ]%;若Cu2S在高温下分解为Cu,则测得加热后得到的固体质量b就会偏小,根据表达式可看出,测得的CuS的质量分数偏大,故答案为:
]%;若Cu2S在高温下分解为Cu,则测得加热后得到的固体质量b就会偏小,根据表达式可看出,测得的CuS的质量分数偏大,故答案为: ![]() ×100%或[
×100%或[![]() ]%;偏大;
]%;偏大;
(6)由题意可知,若反应温度过高,反应时间过长,容易产生CuS和Cu2S固体,故答案为:控制温度不宜过高,反应时间不宜过长。

 阅读快车系列答案
阅读快车系列答案【题目】(一)A、B、C、D、E、X是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。

(1)若A为常见的金属单质,且其焰色反应呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式:___。
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,则X可能为__(填字母)。
a.NaHCO3 b.Na2CO3 c.Al(OH)3 d.NaAlO2
(3)若A为淡黄色粉末,则A的电子式为___。若X为一种最常见的造成温室效应的气体。则鉴别等浓度的D、E两种溶液,可选择的试剂为___。(填字母)
a.盐酸 b.CaCl2溶液 c.氨水 d.澄清石灰水
(二)工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度均为0.1mol![]() L-1。
L-1。
阳离子 | K+、Cu2+、Fe3+、Al3+、Fe2+ |
阴离子 | Cl-、CO32-、NO3-、SO42-、SiO32- |
某同学欲探究该废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ 中所得溶液中加入BaCl2溶液,有白色沉淀生成。
请回答下列问题:
(1)甲同学最终确定原溶液中所含阳离子有___,阴离子是有___。(写离子符号)
(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式为___。
(3)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体的质量为__g。
【题目】工业上制取CuCl2的生产流程如下:
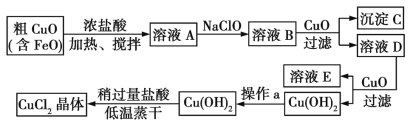
请结合下表数据,回答问题:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
溶度积(25 ℃) | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
(1)在溶液A中加入NaClO的目的是________________________。
(2)在溶液B中加入CuO的作用是________________________________。
(3)操作a的目的是__________________________。
(4)在Cu(OH)2中加入盐酸使Cu(OH)2转化为CuCl2,采用稍过量盐酸和低温蒸干的目的是________________。