题目内容
【题目】“重油—氧气—熔融碳酸钠”燃料电池装置如图所示。下列说法不正确的是( )
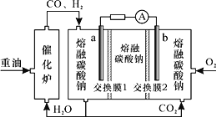
A.b为电池的正极
B.放电过程中,电子由电极a经导线流向电极b
C.该电池工作时,CO32-经交换膜2移向b极
D.H2参与的电极反应为:H2-2e-+CO32-=H2O+CO2
【答案】C
【解析】
燃料电池中,通入燃料的一极为负极,通入氧气的一极为正极,根据装置所示,a电极通入燃料CO和H2为负极,b电极通入氧气为正极,据此分析。
A.根据分析,通入氧气一极为正极,发生还原反应,所以O2在b极得电子,最终被还原为CO32,故A正确;
B.原电池中电子沿导线流向正极,所以放电过程中,电子由电极a经导线流向电极b,故B正确;
C.原电池中阴离子向负极移动,所以CO32经“交换膜2”移向a极,故C错误;
D.负极氢气发生氧化反应,电极反应式:H22e+CO32═H2O+CO2,故D正确;
答案选C。

练习册系列答案
 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目