题目内容
【题目】(一)A、B、C、D、E、X是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。

(1)若A为常见的金属单质,且其焰色反应呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式:___。
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,则X可能为__(填字母)。
a.NaHCO3 b.Na2CO3 c.Al(OH)3 d.NaAlO2
(3)若A为淡黄色粉末,则A的电子式为___。若X为一种最常见的造成温室效应的气体。则鉴别等浓度的D、E两种溶液,可选择的试剂为___。(填字母)
a.盐酸 b.CaCl2溶液 c.氨水 d.澄清石灰水
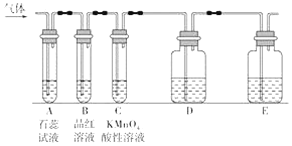
(二)工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度均为0.1mol![]() L-1。
L-1。
阳离子 | K+、Cu2+、Fe3+、Al3+、Fe2+ |
阴离子 | Cl-、CO32-、NO3-、SO42-、SiO32- |
某同学欲探究该废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ 中所得溶液中加入BaCl2溶液,有白色沉淀生成。
请回答下列问题:
(1)甲同学最终确定原溶液中所含阳离子有___,阴离子是有___。(写离子符号)
(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式为___。
(3)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体的质量为__g。
【答案】OH-+HSO3-=SO32-+H2O b ![]() ab Fe2+、Cu2+ Cl-、NO3-、SO42- 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O 1.6
ab Fe2+、Cu2+ Cl-、NO3-、SO42- 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O 1.6
【解析】
(一)、(1)若A为常见的金属单质,焰色反应呈黄色,则A为Na,Na和水反应生成NaOH和氢气,X能使品红溶液褪色,则X是SO2,C为NaOH,B为H2,D能和SO2反应,则D是Na2SO3、E是NaHSO3;
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,A是Cl2,氯气和水反应生成HCl和HClO,C和X反应生成D、D能和X反应生成E,盐酸能和碳酸钠、亚硫酸钠反应且是两步反应;
(3)若A为淡黄色粉末,且能和水反应,则A为Na2O2,若X为一种造成温室效应的气体,X是CO2,过氧化钠和水反应生成NaOH和氧气,NaOH和CO2反应先生成Na2CO3,二氧化碳过量时生成NaHCO3;
(二)、用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察),判断无钾离子;取少量溶液,加入KSCN溶液无明显变化,无三价铁离子;另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,判断红棕色气体为二氧化氮,无色气体为一氧化氮;此时溶液依然澄清,推断溶液中含有NO3-和Fe2+;且溶液中阴离子种类不变,各离子的物质的量均为0.1mol,根据电荷守恒可知还应含有Cu2+,若向原溶液中加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体是氧化铁和氧化铜,根据铁原子、铜原子守恒计算固体质量,根据反应3Fe2++4H++NO3-=3Fe3++NO↑+2H2O的离子方程式计算相关物理量。
(一)、(1)若A为常见的金属单质,焰色反应呈黄色,则A为Na,Na和水反应生成NaOH和氢气,X能使品红溶液褪色,则X是SO2,C为NaOH,B为H2,D能和SO2反应,则D是Na2SO3、E是NaHSO3;C是NaOH,E是亚硫酸氢钠,二者反应离子方程式为OH-+HSO3-=SO32-+H2O,故答案为:OH-+HSO3-=SO32-+H2O;
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,A是Cl2,氯气和水反应生成HCl和HClO,C和X反应生成D、D能和X反应生成E,盐酸能和碳酸钠、亚硫酸钠反应且是两步反应,通过以上分析知,X可能为Na2CO3、Na2SO3,故选b;答案为:b;
(3)若A为淡黄色粉末,且能和水反应,则A为Na2O2,Na2O2的电子式为![]() ,若X为一种造成温室效应的气体,D是碳酸钠、E是碳酸氢钠,可以用盐酸、氯化钙检验碳酸钠、碳酸氢钠,故选ab;故答案为:
,若X为一种造成温室效应的气体,D是碳酸钠、E是碳酸氢钠,可以用盐酸、氯化钙检验碳酸钠、碳酸氢钠,故选ab;故答案为:![]() ;ab;
;ab;
(二)、(1)若向溶液中加入KSCN溶液,无明显变化,说明原溶液中不含Fe3+;若向溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变,说明原溶液中含有Cl-,该气体只能是NO,说明含有具有氧化性的NO3-和还原性的Fe2+,若向溶液中加入BaCl2溶液,有白色沉淀生成,说明原溶液中含有SO42-,各离子的物质的量均为0.1mol,根据电荷守恒可知还应含有Cu2+,所以原溶液中所含阳离子是Fe2+、Cu2+;阴离子是NO3-、Cl-、SO42-,故答案为:Fe2+、Cu2+;NO3-、Cl-、SO42-;
(2))Ⅲ中加入少量盐酸生成无色气体,是Fe2+与NO3-和H+反应生成NO,其离子方程式:3Fe2++NO3-+4H+═3Fe3++NO+2H2O;故答案为:3Fe2++NO3-+4H+═3Fe3++NO+2H
(3)原溶液中所含阳离子是Fe2+、Cu2+,若向原溶液中加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体是CuO、Fe2O3,根据题意各离子的物质的量均为0.01mol可知m(CuO)=0.01mol×80g/mol=0.8g,m(Fe2O3)=![]() ×0.01mol×160g/mol=0.8g,所得固体的质量为0.8g+0.8g=1.6g,故答案为:1.6。
×0.01mol×160g/mol=0.8g,所得固体的质量为0.8g+0.8g=1.6g,故答案为:1.6。