题目内容
【题目】25 ℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO | NH3·H2O | H2SO3 |
电离平衡常数 | 1.8×10-5 | K1=4.2×10-7 K2=5.6×10-11 | 4.7×10-8 | 1.8×10-5 | Ka1=1.3×102 Ka2=6.2×108 |
(1)25℃时,等浓度的Na2CO3溶液、CH3COONa溶液、Na2SO3溶液,3种溶液的pH由大到小的顺序为____________________________________________。
(2)工业上可用氨水除去尾气SO2。
①若氨水的浓度为2.0 mol·L-1,溶液中的c(OH)=________mol·L1。向该氨水中加入少量NH4Cl固体,溶液的pH__________(填“升高”或“降低”);若加入少量明矾,溶液中NH![]() 的浓度____________(填“增大”或“减小”)。
的浓度____________(填“增大”或“减小”)。
②将SO2通入氨水中,当c(OH)降至1.0×107 mol·L1时,溶液中的c(![]() )/c(
)/c(![]() )=_________________。
)=_________________。
(3)若某溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)
___________c(NH3·H2O)(填“大于”、“小于”或“等于”,下同);混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)____________c(OH-)。
(4)根据表中所给的信息,向NaClO溶液中通入少量CO2气体,发生反应的离子方程式为____________________________________________________
【答案】 Na2CO3溶液、Na2SO3溶液、CH3COONa溶液 6.0×10-3 降低 增大 0.62 小于 大于 ClO-+CO2+H2O=HClO+HCO3-
【解析】(1)①依据图表数据分析,电离常数CH3COOH>![]() >
>![]() ,所以等浓度的Na2CO3溶液、CH3COONa溶液、Na2SO3溶液水解程度Na2CO3溶液>Na2SO3溶液>CH3COONa溶液,溶液pH为Na2CO3溶液的>Na2SO3溶液的>CH3COONa溶液的;(2)①若氨水的浓度为2.0 mol·L-1,根据电离常数可知,溶液中的c(OH)=
,所以等浓度的Na2CO3溶液、CH3COONa溶液、Na2SO3溶液水解程度Na2CO3溶液>Na2SO3溶液>CH3COONa溶液,溶液pH为Na2CO3溶液的>Na2SO3溶液的>CH3COONa溶液的;(2)①若氨水的浓度为2.0 mol·L-1,根据电离常数可知,溶液中的c(OH)=![]() =
=![]() mol·L1=6.0
mol·L1=6.0![]() mol·L1;向该氨水中加入少量NH4Cl固体,铵根离子浓度增大,抑制氨水的电离,氢氧根离子浓度减小,溶液的pH降低;若加入少量明矾,铝离子的水解促进氨水的电离,溶液中NH
mol·L1;向该氨水中加入少量NH4Cl固体,铵根离子浓度增大,抑制氨水的电离,氢氧根离子浓度减小,溶液的pH降低;若加入少量明矾,铝离子的水解促进氨水的电离,溶液中NH![]() 的浓度增大;②根据H2SO3的Ka2=6.2×108可知,
的浓度增大;②根据H2SO3的Ka2=6.2×108可知, 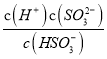 =6.2×108,当c(OH)降至1.0×107 mol·L1时,溶液中的
=6.2×108,当c(OH)降至1.0×107 mol·L1时,溶液中的 =0.62;(3)25℃时,将a molL-1稀盐酸和bmolL-1氨水混合而成等体积混合后,溶液呈中性,则混合后溶液的pH=7,当a=b时,两溶液恰好反应生成氯化铵,溶液显示酸性,若使溶液的pH=7,则一水合氨的浓度应该稍大一些,即a<b,故c(HCl) 小于c(NH3·H2O);酸是强酸完全电离,碱是弱碱不完全电离且反应后促进碱的电离后氢氧根离子浓度等于氢离子浓度,故混合前酸中c(H+)大于碱中c(OH-);(4)根据表中所给的信息,电离常数H2CO3> HClO > HCO3-,故向NaClO溶液中通入少量CO2气体,发生反应的离子方程式为:ClO-+CO2+H2O=HClO+HCO3-。
=0.62;(3)25℃时,将a molL-1稀盐酸和bmolL-1氨水混合而成等体积混合后,溶液呈中性,则混合后溶液的pH=7,当a=b时,两溶液恰好反应生成氯化铵,溶液显示酸性,若使溶液的pH=7,则一水合氨的浓度应该稍大一些,即a<b,故c(HCl) 小于c(NH3·H2O);酸是强酸完全电离,碱是弱碱不完全电离且反应后促进碱的电离后氢氧根离子浓度等于氢离子浓度,故混合前酸中c(H+)大于碱中c(OH-);(4)根据表中所给的信息,电离常数H2CO3> HClO > HCO3-,故向NaClO溶液中通入少量CO2气体,发生反应的离子方程式为:ClO-+CO2+H2O=HClO+HCO3-。

【题目】向2 L密闭容器中加入一定量的固体A和气体B,发生反应A(s)+2B(g) ![]() D(g)+E(g)ΔH=Q kJ·mol-1。在T1 ℃时,反应进行到不同时间测得各物质的物质的量如表:
D(g)+E(g)ΔH=Q kJ·mol-1。在T1 ℃时,反应进行到不同时间测得各物质的物质的量如表:
时间(min) 物质的量(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
(1)T ℃时,该反应的平衡常数K=____________________________。
(2)30 min后,只改变某一条件,反应重新达到平衡,据表中数据判断改变的条件可能是_____(填编号)。
a.通入一定量的B b.加入一定量的固体A c.适当缩小容器的体积
d.升高反应体系温度 e.同时加入0.2 mol B、0.1 mol D、0.1 mol E
(3)对于该反应,用各物质表示的反应速率与时间的关系示意曲线为下图中的____________(填序号)。
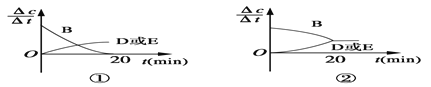

(4)容器的体积和温度T1 ℃不变,向该容器中加入1.60 mol B、0.20 mol D、0.20 mol E和n mol A,达到平衡后,与表格中20分钟时各物质的浓度完全相同,投入固体A的物质的量n的取值范围是______。
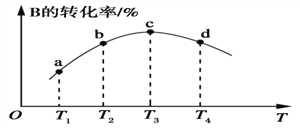
(5)若该密闭容器绝热,实验测得B的转化率随温度变化的示意图如图所示。由图可知,Q________0(填“大于”或“小于”),c点v正________v逆(填“大于”、“小于”或“等于”)。