题目内容
【题目】电解精炼铜的阳极泥中主要含Ag、Au等贵重金属。以下是从精炼铜的阳极泥中回收银、金的流程图:

(1)氯金酸(HAuCl4)中的Au的化合价为________。
(2)“焙烧渣”在“①酸浸”时发生反应的离子方程式为_________。
(3)铜阳极泥氧化时,采用“低温焙烧”而不采用“高温焙烧”的原因是________。
(4)已知N2H4被银氨溶液氧化的产物是氮气,则每生成1molAg,需要消耗_______g N2H4。
(5)氯金酸(HAuCl4)在pH为2~3的条件下被草酸还原为Au,同时放出二氧化碳气体,则该反应的化学方程式为____________。
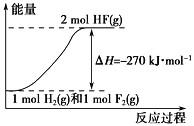
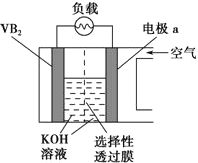
(6)阳极泥中的铜可以用FeC13溶液浸出,所得溶液主要含有的阳离子为Cu2+、Fe3+和Fe2+;结合右图分析(其中的纵坐标代表金属阳离子浓度的对数):

①要从浸出液中提纯铜,最好先加入酸化的双氧水,目的是___________________________________,然后加入适量的CuO调节pH=3.7,除去________离子;
②从图中数据计算可得Cu(OH)2的Ksp约为____________________。
【答案】 +3 Ag2O + 2H+ +2Cl- ![]() 2AgCl+H2O 高温焙烧时,生成的Ag2O又分解为Ag和O2(或2Ag2O
2AgCl+H2O 高温焙烧时,生成的Ag2O又分解为Ag和O2(或2Ag2O![]() 4Ag+O2) 8 2HAuCl4 + 3H2C2O4
4Ag+O2) 8 2HAuCl4 + 3H2C2O4 ![]() 2Au + 8HCl + 6CO2↑ 将Fe2+氧化为Fe3+ Fe3+ 1.0×10-20
2Au + 8HCl + 6CO2↑ 将Fe2+氧化为Fe3+ Fe3+ 1.0×10-20
【解析】分析:本题考查化学工艺流程,各步生产流程中通过过滤分离固体和溶液。通过得失电子守恒和原子守恒配平化学方程式,依据化学方程式进行计算;依据溶度积公式计算溶度积。
详解:(1)氯金酸(HAuCl4)中的H元素为+1,Cl元素为-1,由化合价代数和为0得到Au元素的化合价为+3;
(2)由流程图可知,“焙烧渣”在“①酸浸”时,Ag2O与盐酸反应生成AgCl和H2O,反应的离子方程式为Ag2O +2H++2Cl-==2AgCl+H2O;
因为Ag2O高温焙烧分解为Ag和O2,所以铜阳极泥氧化时,采用“低温焙烧”而不采用“高温焙烧”的原因是防止反应生成的Ag2O又分解为Ag和O2;
(4)由题意可知,N2H4被Ag(NH3)2+氧化为N2,Ag(NH3)2+被N2H4还原为Ag,反应的离子方程式为:4Ag(NH3)2++ N2H4 + 4OH-![]() 4Ag+N2+4H2O+8NH3;每生成1molAg,需要消耗0.25mol N2H4,质量为0.25mol×32g/mol=8g。
4Ag+N2+4H2O+8NH3;每生成1molAg,需要消耗0.25mol N2H4,质量为0.25mol×32g/mol=8g。
(5)由题意可知,酸性条件下HAuCl4被草酸还原为Au,草酸被HAuCl4氧化为二氧化碳,反应的化学方程式为:2HAuCl4+ 3H2C2O4![]() 2Au + 8HCl + 6CO2↑。
2Au + 8HCl + 6CO2↑。
(6)①要从浸出液中提纯铜,需要先将Fe2+氧化为Fe3+ ,然后加入适量的CuO调节pH=3.7,生成氢氧化铁沉淀,除去Fe3+ 离子;②Ksp[Cu(OH)2]=c(Cu2+)c2(OH-),由图可知,pH=6时,lgc(Cu2+)=-4,c(Cu2+)=10-4mol/L,c(OH-)=10-8mol/L,Ksp[Cu(OH)2]=c(Cu2+)c2(OH-)=10-4×(10-8)2=1.0×10-20,因此,本题答案为:将Fe2+氧化为Fe3+ ; Fe3+ ; 1.0×10-20。

【题目】25 ℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO | NH3·H2O | H2SO3 |
电离平衡常数 | 1.8×10-5 | K1=4.2×10-7 K2=5.6×10-11 | 4.7×10-8 | 1.8×10-5 | Ka1=1.3×102 Ka2=6.2×108 |
(1)25℃时,等浓度的Na2CO3溶液、CH3COONa溶液、Na2SO3溶液,3种溶液的pH由大到小的顺序为____________________________________________。
(2)工业上可用氨水除去尾气SO2。
①若氨水的浓度为2.0 mol·L-1,溶液中的c(OH)=________mol·L1。向该氨水中加入少量NH4Cl固体,溶液的pH__________(填“升高”或“降低”);若加入少量明矾,溶液中NH![]() 的浓度____________(填“增大”或“减小”)。
的浓度____________(填“增大”或“减小”)。
②将SO2通入氨水中,当c(OH)降至1.0×107 mol·L1时,溶液中的c(![]() )/c(
)/c(![]() )=_________________。
)=_________________。
(3)若某溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)
___________c(NH3·H2O)(填“大于”、“小于”或“等于”,下同);混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)____________c(OH-)。
(4)根据表中所给的信息,向NaClO溶液中通入少量CO2气体,发生反应的离子方程式为____________________________________________________