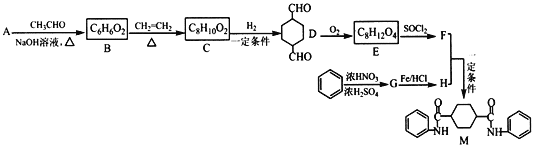
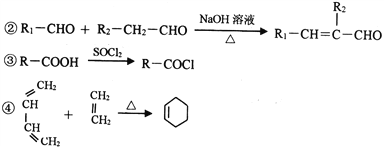
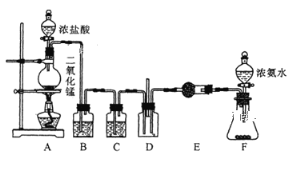
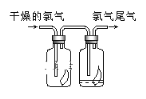
题目内容
【题目】一定条件下,将NO2 与SO2 以体积比1:2 置于恒容密闭容器中发生反应:![]() 。下列能说明该反应达到平衡状态的是
。下列能说明该反应达到平衡状态的是
A. v(SO3 ) = v(NO2 ) B. 混合气体的密度保持不变
C. 混合气体的颜色保持不变 D. 每消耗1 mol SO3的同时生成1 mol NO2
【答案】C
【解析】A. v(SO3 ) = v(NO2 )并不能说明正反应速率和逆反应速率相等;B. 混合气体的密度一直不变,所以无法根据密度判断是否达到平衡;C. 混合气体的颜色保持不变 ,说明反应混合物中各组分的浓度保持不变,达到平衡;D. 每消耗1 mol SO3的同时生成1 mol NO2,只有逆反应速率,不能说明正反应速率和逆反应速率相等。本题选C。

 名校课堂系列答案
名校课堂系列答案【题目】25 ℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO | NH3·H2O | H2SO3 |
电离平衡常数 | 1.8×10-5 | K1=4.2×10-7 K2=5.6×10-11 | 4.7×10-8 | 1.8×10-5 | Ka1=1.3×102 Ka2=6.2×108 |
(1)25℃时,等浓度的Na2CO3溶液、CH3COONa溶液、Na2SO3溶液,3种溶液的pH由大到小的顺序为____________________________________________。
(2)工业上可用氨水除去尾气SO2。
①若氨水的浓度为2.0 mol·L-1,溶液中的c(OH)=________mol·L1。向该氨水中加入少量NH4Cl固体,溶液的pH__________(填“升高”或“降低”);若加入少量明矾,溶液中NH![]() 的浓度____________(填“增大”或“减小”)。
的浓度____________(填“增大”或“减小”)。
②将SO2通入氨水中,当c(OH)降至1.0×107 mol·L1时,溶液中的c(![]() )/c(
)/c(![]() )=_________________。
)=_________________。
(3)若某溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)
___________c(NH3·H2O)(填“大于”、“小于”或“等于”,下同);混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)____________c(OH-)。
(4)根据表中所给的信息,向NaClO溶液中通入少量CO2气体,发生反应的离子方程式为____________________________________________________