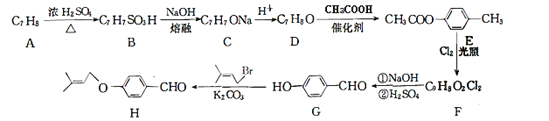
题目内容
【题目】磷化铝、磷化锌、磷化钙与水反应产生高毒的PH3气体(熔点为-132℃,还原性强、易自燃),可用于粮食熏蒸杀虫。卫生安全标准规定:当粮食中磷化物(以PH3计)的含量低于0.05mg·kg-1时算合格。可用以下方法测定粮食中残留的磷化物含量:

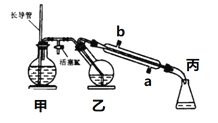
(操作流程)安装吸收装置→PH3的产生与吸收→转移KMnO4吸收溶液→亚硫酸钠标准溶液滴定。
(实验装置)C中盛100 g原粮,D中盛有 20.00 mL 1.12×10-4 mol L-1KMnO4溶(H2SO4酸化)。
请回答下列问题:
(1)仪器C的名称是__________________;
(2)以磷化钙为例,写出磷化钙与水反应的化学方程式____________________;检查整套装置气密性良好的方法是_____________________________________。
(3)A中盛装KMnO4溶液的作用是______________________;通入空气的作用是____________。若没有B装置,则实验中测得PH3含量将____________(填“偏低”、“偏高”或“不变”)
(4)D中PH3被氧化成磷酸,所发生反应的离子方程式为_________________________。
(5)把D中吸收液转移至容量瓶中,加水稀释至250mL,取25.00mL于锥形瓶中,用5.0×10-5mol L-1的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液11.00mL,则该原粮中磷化物(以PH3计)的含量为______mg kg-1。
【答案】 三颈烧瓶 Ca3P2+6H2O===3 Ca (OH)2+2PH3↑ 关闭K1、打开K2用抽气泵缓慢抽气,若观察到A、B、D各装置中有气泡产生则气密性良好 [或在D左边用橡胶管和止水夹封闭、关闭K2用压差法;或关闭分液漏斗旋塞后对C加热法] 除去空气中的还原性气体 吹出PH3,使其全部被酸性KMnO4溶液吸收 偏低 5PH3+8MnO4-+24H+==5H3PO4+8Mn2++12H2O 0.0085
【解析】分析:本题为综合实验题。主要考察磷化氢制备的原理、装置气密性的检查方法;高锰酸钾溶液为强氧化剂,因此装置中盛放该试剂的作用除去还原性气体;为了保证实验的准确性,利用空气把PH3全部带入到高锰酸钾溶液中进行吸收;最后根据反应的方程式中物质之间的关系计算出样品中PH3含量。
详解:(1) 仪器C为反应的发生器,名称是三颈烧瓶;正确答案:三颈烧瓶。
(2) 磷化钙与水反应生成磷化氢和氢氧化钙,反应的化学方程式:Ca3P2+6H2O===3Ca (OH)2+2PH3↑;检查整套装置气密性方法:关闭K1、打开K2用抽气泵缓慢抽气,若观察到A、B、D各装置中有气泡产生则气密性良好 [或在D左边用橡胶管和止水夹封闭、关闭K2用压差法;或关闭分液漏斗旋塞后对C加热法] ;正确答案:Ca3P2+6H2O===3Ca (OH)2+2PH3↑;关闭K1、打开K2用抽气泵缓慢抽气,若观察到A、B、D各装置中有气泡产生则气密性良好 [或在D左边用橡胶管和止水夹封闭、关闭K2用压差法;或关闭分液漏斗旋塞后对C加热法]。
(3) 依据装置图进行分析判断,高锰酸钾溶液是强氧化剂,可以吸收空气中的还原性气体;通入空气,吹出PH3,使其全部被酸性KMnO4溶液吸收,减小实验误差;B中盛装焦性没食子酸的碱性溶液,其作用是吸收空气中的氧气,防止氧化装置C中生成的PH3, 若没有B装置,PH3部分被氧气氧化,则实验中测得PH3含量将偏低;正确答案:除去空气中的还原性气体 ; 吹出PH3,使其全部被酸性KMnO4溶液吸收; 偏低。
(4) PH3被酸性高锰酸钾氧化成磷酸,高锰酸钾被还原为锰离子,结合电子守恒和电荷守恒、原子守恒配平书写得到离子方程式为:5PH3+8MnO4-+24H+==5H3PO4+8Mn2++12H2O;正确答案:5PH3+8MnO4-+24H+==5H3PO4+8Mn2++12H2O。
(5) 根据2KMnO4+5Na2SO3+3H2SO4=2MnSO4+K2SO4+5Na2SO4+3H2O反应可知,25毫升溶液中剩余KMnO4的量为[5.0×10-5×11×10-3]×2/5mol,那么250毫升溶液中剩余KMnO4的量为5.0×10-5×11×10-3×10mol,由于D中盛有KMnO4的量为20×1.12×10-4×10-3 mol,所以参加反应的KMnO4的量2.24×10-6-2.2×10-6=0.04×10-6 mol,根据5PH3+8MnO4-+24H+==5H3PO4+8Mn2++12H2O反应关系可知,消耗PH3的量为[4×10-8]×5/8mol;C中盛100g原粮,含有PH3的量[4×10-8]×5/8 mol,质量为85×10-8g,则该原粮中磷化物(以PH3计)的含量为0.0085 mg kg-1;正确答案:0.0085。
点睛;本题在进行最后一问计算时,要根据反应关系计算出参与反应的酸性高锰酸钾溶液的量,但是要注意这是量取25毫升溶液中消耗高锰酸钾的量,计算总量时要注意是250毫升样品溶液,也就是得扩大10倍才能进行准确计算,否则误差相差太大。

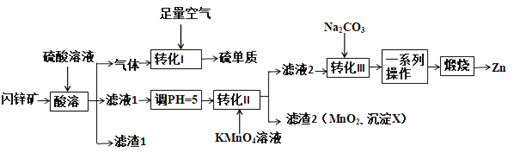
【题目】TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:
![]()
资料:TiCl4及所含杂质氯化物的性质
化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
沸点/℃ | 58 | 136 | 181(升华) | 316 | 1412 |
熔点/℃ | 69 | 25 | 193 | 304 | 714 |
在TiCl4中的溶解性 | 互溶 | —— | 微溶 | 难溶 | |
(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1
① 沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:____________________。
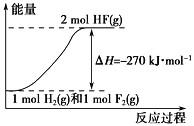
② 氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH_____0(填“>”“<”或“=”),判断依据:_______________。

③ 氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是__________________________。
④ 氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_____________。
(2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下:

物质a是______________,T2应控制在_________。
【题目】25 ℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO | NH3·H2O | H2SO3 |
电离平衡常数 | 1.8×10-5 | K1=4.2×10-7 K2=5.6×10-11 | 4.7×10-8 | 1.8×10-5 | Ka1=1.3×102 Ka2=6.2×108 |
(1)25℃时,等浓度的Na2CO3溶液、CH3COONa溶液、Na2SO3溶液,3种溶液的pH由大到小的顺序为____________________________________________。
(2)工业上可用氨水除去尾气SO2。
①若氨水的浓度为2.0 mol·L-1,溶液中的c(OH)=________mol·L1。向该氨水中加入少量NH4Cl固体,溶液的pH__________(填“升高”或“降低”);若加入少量明矾,溶液中NH![]() 的浓度____________(填“增大”或“减小”)。
的浓度____________(填“增大”或“减小”)。
②将SO2通入氨水中,当c(OH)降至1.0×107 mol·L1时,溶液中的c(![]() )/c(
)/c(![]() )=_________________。
)=_________________。
(3)若某溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)
___________c(NH3·H2O)(填“大于”、“小于”或“等于”,下同);混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)____________c(OH-)。
(4)根据表中所给的信息,向NaClO溶液中通入少量CO2气体,发生反应的离子方程式为____________________________________________________