题目内容
11. (1)已知 2Na+2H2O=2NaOH+H2↑中水是氧化剂,请写出一个水做还原剂的置换反应的化学反应方程式2F2+2H2O=4HF+O2↑
(1)已知 2Na+2H2O=2NaOH+H2↑中水是氧化剂,请写出一个水做还原剂的置换反应的化学反应方程式2F2+2H2O=4HF+O2↑(2)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气,写出该反应的离子方程式MnO2+2Cl-+4H+═Mn2++Cl2↑+2H2O
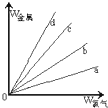
(3)在如图的四条直线分别表示钠、铜、铝、铁与足量Cl2反应时,消耗金属的质量(纵轴)与反应掉的氯气质量(横轴)的关系,其中代表铜与Cl2反应的直线是d,如果横轴表示消耗掉的硫的质量,则c表示的是四种金属中的Fe
(4)硫酸铜溶液与碘化钾溶液反应,生成一种能使淀粉溶液变蓝的单质和一种含有两种元素的物质,当有0.5molCuSO4参加反应时转移电子数为3,.01×1023,写出符合此反应的离子方程式2Cu2++4I-=2CuI↓+I2.
分析 (1)氟气与水反应生成氢氟酸和氧气,反应中水做还原剂;
(2)二氧化锰在加热条件下能够氧化浓盐酸生成氯气;
(3)依据反应1molCl2,则分别消耗2molNa、1molCu、$\frac{2}{3}$molAl和$\frac{2}{3}$molFe;
反应1mol硫,分别消耗2molNa、2molCu、$\frac{2}{3}$molAl和1molFe;
(4)硫酸铜溶液与碘化钾溶液反应,生成一种能使淀粉溶液变蓝的单质和一种含有两种元素的物质,说明该反应中有单质生成,I元素失电子发生氧化反应,则还有得电子的元素,为Cu元素,当有0.5mol CuSO4参加反应时转移电子数为3.01×1023,硫酸铜和转移电子的物质的量之比为1:1,说明生成的Cu元素显+1价,则为CuI.
解答 解:(1)氟气与水反应生成氢氟酸和氧气,反应中水做还原剂,方程式为:2F2+2H2O=4HF+O2↑,属于置换反应,
故答案为:2F2+2H2O=4HF+O2↑;
(2)二氧化锰在加热条件下能够氧化浓盐酸生成氯气,离子方程式为:MnO2+2Cl-+4H+═Mn2++Cl2↑+2H2O;
故答案为:MnO2+2Cl-+4H+═Mn2++Cl2↑+2H2O;
(3)反应1molCl2,则分别消耗2molNa、1molCu、$\frac{2}{3}$molAl和$\frac{2}{3}$molFe,消耗四种金属的质量分别为:钠:46g、镁:64g、铝:18g、铁:37.3g;
所以消耗相同量的氯气,消耗铜的质量最大,d符合质量关系;
反应1mol硫,分别消耗2molNa、2molCu、$\frac{2}{3}$molAl和1molFe,消耗四种金属的质量分别为:钠:46g、铜:128g、铝:18g、铁:56g;
所以消耗相同量的硫,消耗铁的质量仅次于铜,铁符合C;
故答案为:d;Fe;
(4)硫酸铜溶液与碘化钾溶液反应,生成一种能使淀粉溶液变蓝的单质和一种含有两种元素的物质,说明该反应中有单质生成,I元素失电子发生氧化反应,则还有得电子的元素,为Cu元素,当有0.5mol CuSO4参加反应时转移电子数为3.01×1023,硫酸铜和转移电子的物质的量之比为1:1,说明生成的Cu元素显+1价,则为CuI,所以离子反应方程式为2Cu2++4I-=2CuI↓+I2,
故答案为:2Cu2++4I-=2CuI↓+I2.
点评 本题考查了不同金属的性质及离子方程式的计算、图象分析,明确各种金属的性质是解题关键,注意硫与变价金属生成低价态硫化物,氯气氧化性强,与变价金属反应生成高价态氯化物,题目难度不大.

| A. | H2+2OH-=2H2O+2e- | B. | O2+4H++4e-=2H2O | ||
| C. | H2-2e-=2H+ | D. | O2+2H2O+4e-=4OH- |
| A. | 蒸馏操作时,先得到的少量液体可能会与器壁等接触而含杂质较多,可以弃掉 | |
| B. | 分液操作时,首先要打开分液漏斗的上口活塞,或使活塞上的小孔与上口部的小孔对准,然后进行分液 | |
| C. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 萃取分液后,要得到被萃取的物质,通常还要进行蒸馏,为了更好的控制温度,用水浴加热比直接加热要好 |
| A. | 20g重水(D2O)含有的电子数为10 NA | |
| B. | 46g NO2和N2O4的混合物中所含氧原子个数为6.02×1023 | |
| C. | 0.1mol过氧化钠与足量的水反应,转移的电子数为 0.2NA | |
| D. | 1L 0.3 mol/LNa2SO4溶液中,含有Na+和SO42-总数为0.6 NA |
 氨气是生产化肥、硝酸等的重要原料,围绕合成氨人们进行了一系列的研究
氨气是生产化肥、硝酸等的重要原料,围绕合成氨人们进行了一系列的研究(1)氢气既能与氮气又能与氧气发生反应,但是反应的条件却不相同.已知:
2H2(g)+O2(g)=2H2O (g)△H=-483.6kJ/mol
3H2 (g)+N2(g) 2NH3(g)△H=-92.4kJ/mol
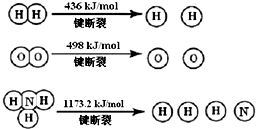
计算断裂1mol N≡N键需要能量946kJ,氮气分子中化学键比氧气分子中的化学键键强(填“强”或“弱”),因此氢气与二者反应的条件不同.
(2)固氮是科学家致力研究的重要课题.自然界中存在天然的大气固氮过程:N2(g)+O2(g)=2NO (g)△H=+180.8kJ/mol,工业合成氨则是人工固氮.分析两种固氮反应的平衡常数,下列结论正确的是BC.
| 反应 | 大气固氮 | 工业固氮 | ||||
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
B.人类大规模模拟大气固氮是无意义的
C.工业固氮温度越低,氮气与氢气反应越完全
D.K越大说明合成氨反应的速率越大.
| A. | 分液漏斗中液体的总体积不得超过其容量的2/3 | |
| B. | 萃取时,用右手压住分液漏斗的玻璃塞,左手握住旋塞,将分液漏斗倒过来用力震荡 | |
| C. | 分液漏斗的检漏只需检查旋塞处是否漏水即可 | |
| D. | 课本中测定中和热实验的装置,用铜制环形搅棒代替玻璃环形搅棒更耐用 |
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Al、Mg | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、石墨 | 稀盐酸 | 偏向石墨 |
| 4 | Al、Mg | 氢氧化钠 | 偏向Mg |
| 5 | Al、Zn | 稀盐酸 | 偏向Al |
(2)写出实验3中的正极反应式2H++2e-═H2↑.