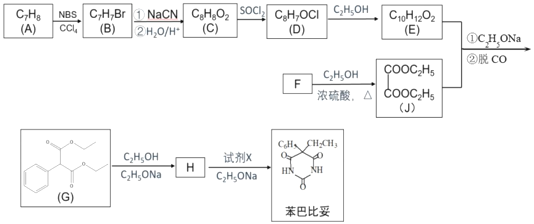
题目内容
【题目】在密闭容器中进行反应:X(g)+3Y(g) ![]() 2Z(g),有关下列图像说法正确的是
2Z(g),有关下列图像说法正确的是
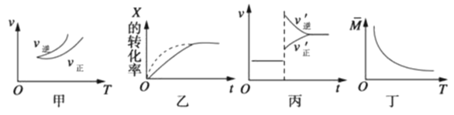
A.依据图甲可判断正反应为吸热反应
B.在图乙中,虚线可表示压强增大
C.若正反应的△H<0,图丙可表示升高温度使平衡向逆反应方向移动
D.由图丁中气体平均相对分子质量随温度的变化情况,可推知正反应的△H>0
【答案】C
【解析】
A、依据图象分析,温度升高逆反应速率大于正反应速率,平衡逆向进行,逆向是吸热反应,正向是放热反应,故A错误;
B、压强增大,平衡正向移动,缩短反应达到平衡的时间,X的转化率变大,故B错误;
C、若正反应的△H<0,是放热反应升温平衡逆向进行,逆反应速率大于正反应速率,图象符合反应速率的变化,故C正确;
D、图象分析,温度升高平均相对分子质量减小,平均分子质量减小,总质量不变,说明气体物质的量变大,所以平衡逆向进行,逆反应是吸热反应,正反应是放热反应△H<0,故D错误;
故选:C。

 导学教程高中新课标系列答案
导学教程高中新课标系列答案【题目】在一定温度下,将气体X和气体Y 各0.16 mol充入10 L 恒容密闭容器中,发生反应:X(g)+ Y(g)![]() 2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表。下列说法正确的是
2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表。下列说法正确的是
t / min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前2min的平均速率v(Z)=2.0×10-5 mol/(L·min)
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的物质的量浓度减小
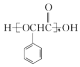
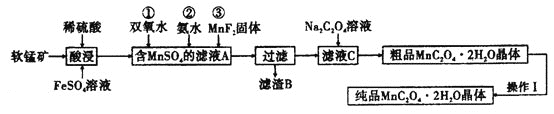
【题目】![]() 是一种常见的化学试剂,是制备其他含锰化合物的重要原料。某课外化学兴趣小组利用软锰矿
是一种常见的化学试剂,是制备其他含锰化合物的重要原料。某课外化学兴趣小组利用软锰矿![]() 主要成分为
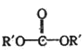
主要成分为![]() ,含少量
,含少量![]() 、
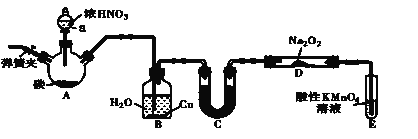
、![]() 和
和![]() 制备
制备![]() ,设计流程如图:
,设计流程如图:![]() 注:试剂①②③按编号顺序加入
注:试剂①②③按编号顺序加入![]()
已知:常温时部分难溶化合物的![]() 近似值
近似值![]() 如表:
如表:
物质 |
|
|
|
|
|
|
|
|
|
|
|
(1)该小组同学在酸浸之前,先将软锰矿粉碎,其目的是________。
(2)“酸浸”过程中![]() 发生反应的离子方程式为________。
发生反应的离子方程式为________。
(3)加入![]() 固体的作用是________,甲同学提出将上述流程中的氨水换成氢氧化钠溶液,乙同学觉得不妥,乙同学的理由是________。
固体的作用是________,甲同学提出将上述流程中的氨水换成氢氧化钠溶液,乙同学觉得不妥,乙同学的理由是________。
(4)丙同学认为向滤液C中滴加![]() 溶液的过程中可能会生成
溶液的过程中可能会生成![]() 沉淀,并提出可能的原因为
沉淀,并提出可能的原因为![]() ,常温时,该反应的平衡常数
,常温时,该反应的平衡常数![]() ________
________![]() 填数值
填数值![]() 。
。![]() 已知
已知![]() ,
,![]() 。
。
(5)操作Ⅰ的名称为________。
(6)如图是小组同学将![]() 晶体放在坩埚里加热分解时,固体失重质量分数随温度
晶体放在坩埚里加热分解时,固体失重质量分数随温度![]() 变化的曲线
变化的曲线![]() 已知草酸锰不稳定,但其中锰元素的化合价在
已知草酸锰不稳定,但其中锰元素的化合价在![]() 以下不变
以下不变![]() 。
。
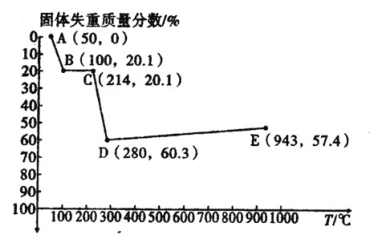
试根据各点的坐标![]() 近似值
近似值![]() 回答下列问题:
回答下列问题:
①![]() 的化学方程式为________。
的化学方程式为________。
②从D点到E点过程中固体失重的质量分数下降的原因是________。