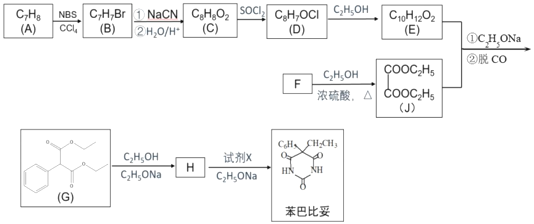
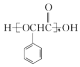
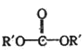
题目内容
【题目】某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等。 水垢会形成安全隐患,需及时清洗除去。清洗流程如下:
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
(1)用NaOH溶解二氧化硅的化学方程式是_________________________。
(2)已知:20℃时溶解度/g
CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
1.4×10-3 | 2.55×10-2 | 9×10-4 | 1.1×10-2 |
则步骤Ⅰ中加入Na2CO3可除去水垢中的______________________。
(3)在步骤Ⅱ中:
①被除掉的水垢除铁锈外,还有____________________________。
②清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因__________________。
(4)步骤Ⅲ中,加入Na2SO3的目的是______________________。(结合离子方程式用文字表达)
(5)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe3O4保护膜。
①完成并配平其反应的离子方程式:
____Fe+____NO2-+____H2O=______N2↑+__________+_______。
②如果有16.8 g铁被钝化,则转移的电子数为___________________(保留三位有效数字)。
【答案】SiO2 + 2NaOH = Na2SiO3 + H2O CaSO4 CaCO3、Mg(OH)2 2Fe3+ + Fe = 3Fe2+ SO32- + 2Fe3+ + H2O = SO42- + 2Fe2+ +2H+,将Fe3+还原成Fe2+,防止Fe3+腐蚀锅炉 9、8、4、4、3Fe3O4、8OH- 4.82×1023
【解析】
(1)NaOH与二氧化硅反应生成硅酸钠和水,反应的化学方程式为SiO2+2NaOH=Na2SiO3+H2O;
(2)由表格中数据可知,碳酸钙更难溶,则清洗CaSO4的过程为CaSO4在水中存在平衡CaSO4(s)Ca2+(aq)+SO42-(aq),用Na2CO3溶液浸泡后,Ca2+与CO32-结合成更难溶的CaCO3,使上述平衡右移,CaSO4转化成CaCO3,然后用盐酸除去,所以步骤Ⅰ中加入Na2CO3可除去水垢中的CaSO4,故答案为:CaSO4;
(3)①加入稀盐酸,盐酸能够溶解碳酸钙、氢氧化镁、铁锈,二氧化硅不溶,因此被除掉的水垢除铁锈外,还有CaCO3、Mg(OH)2,故答案为:CaCO3、Mg(OH)2;
②溶解的铁锈会生成Fe3+,铁与铁离子能够反应,2Fe3++Fe=3Fe2+,加速锅炉腐蚀,故答案为:2Fe3++Fe=3Fe2+;
(4)步骤Ⅲ中,加入Na2SO3,与铁离子发生氧化还原反应,其目的为将Fe3+还原成Fe2+,防止Fe3+腐蚀锅炉,反应的离子方程式为SO32-+2Fe3++H2O=SO42-+2Fe2++2H+,故答案为:SO32-+2Fe3++H2O=SO42-+2Fe2++2H+,将Fe3+还原成Fe2+,防止Fe3+腐蚀锅炉;
(5)①由方程式可知,Fe元素的化合价升高,N元素的化合价降低,由得失电子守恒可知,还生成四氧化三铁,由电荷守恒可知还生成OH-,则该反应的离子方程式为9Fe+8NO2-+4H2O=4N2↑+3Fe3O4+8OH-;
②16.8g铁的物质的量为![]() =0.3mol,钝化时表面生成致密的四氧化三铁,根据氧化还原反应方程式9Fe+8NO2-+4H2O=4N2↑+3Fe3O4+8OH-可知,每9mol铁反应可以转移24mol电子,所以0.3mol铁反应转移
=0.3mol,钝化时表面生成致密的四氧化三铁,根据氧化还原反应方程式9Fe+8NO2-+4H2O=4N2↑+3Fe3O4+8OH-可知,每9mol铁反应可以转移24mol电子,所以0.3mol铁反应转移![]() ×24mol=0.8mol电子,电子数为0.8mol×6.02×1023/mol=4.82×1023,故答案为:4.82×1023。
×24mol=0.8mol电子,电子数为0.8mol×6.02×1023/mol=4.82×1023,故答案为:4.82×1023。

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案