题目内容
【题目】A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
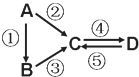
(1)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写出②反应的离子方程式_______________________________________;④反应离子方程式__________________________________________________。
(2)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种黄绿色气体单质。写出A与水高温下反应的化学方程式_________________________________。④反应的离子方程式_________________________。D中加入氢氧化钠的现象_____________________。
(3)若A是太阳能电池用的光伏材料,B常用于制作高档光学器材,C、D为钠盐,C的水溶液俗称水玻璃,D的溶液显碱性。④反应也是通入一种引起温室效应的主要气体。写出③反应的化学方程式___________________________________。⑤反应用到B,反应条件为高温,则⑤的化学方程式为___________________________________________。
【答案】2Al+2OH-+2H2O=2AlO2-+3H2↑ AlO2-+CO2(过量)+2H2O=Al(OH)3↓+HCO3- 3Fe+4H2O(g)![]() Fe3O4+4H2 Fe+2Fe3+=3Fe2+ 生成的白色沉淀迅速变成灰绿色,最后变成红褐色 SiO2+2NaOH=Na2SiO3+H2O SiO2+Na2CO3
Fe3O4+4H2 Fe+2Fe3+=3Fe2+ 生成的白色沉淀迅速变成灰绿色,最后变成红褐色 SiO2+2NaOH=Na2SiO3+H2O SiO2+Na2CO3![]() Na2SiO3+CO2↑
Na2SiO3+CO2↑
【解析】
(1)D物质具有两性,则其为Al2O3或Al(OH)3,因为A是单质,所以A为Al。由②③反应均要用强碱溶液,推知C为NaAlO2,④反应是通入过量的一种引起温室效应的主要气体,则D为Al(OH)3,B为Al2O3。②反应为Al与NaOH溶液反应,生成偏铝酸钠和氢气;④反应为NaAlO2与CO2、H2O等反应,生成Al(OH)3和NaHCO3。
(2)A是应用最广泛的金属Fe,黄绿色气体单质为Cl2,由反应②,可确定C为FeCl3,④反应用到Fe,则D为FeCl2,⑤反应为FeCl2与Cl2的反应。Fe与水高温下反应,生成Fe3O4和H2。④反应为FeCl3与Fe反应,生成FeCl2。FeCl3中加入氢氧化钠,发生复分解反应,生成的Fe(OH)2在空气中逐渐被氧化为Fe(OH)3。
(3)若A是太阳能电池用的光伏材料,则其为Si,B常用于制作高档光学器材,则其为SiO2,C、D为钠盐,C的水溶液俗称水玻璃,则C为Na2SiO3。④反应也是通入一种引起温室效应的主要气体,D的溶液显碱性,则其为Na2CO3。③反应为SiO2与NaOH溶液反应,生成Na2SiO3和水。⑤反应用到B,反应条件为高温,则⑤为SiO2与Na2CO3反应,生成Na2SiO3和CO2气体。
(1)由分析可知,A为Al,B为Al2O3,C为NaAlO2,D为Al(OH)3;反应②为Al与NaOH溶液反应,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;反应④为NaAlO2与CO2、H2O等反应,离子方程式为AlO2-+CO2(过量)+2H2O=Al(OH)3↓+HCO3-;答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;AlO2-+CO2(过量)+2H2O=Al(OH)3↓+HCO3-;
(2)由分析知,A为Fe,黄绿色气体为Cl2,C为FeCl3,D为FeCl2;Fe与水高温下反应,化学方程式为3Fe+4H2O(g)![]() Fe3O4+4H2;反应④为FeCl3与Fe反应,离子方程式为Fe+2Fe3+=3Fe2+;FeCl3中加入氢氧化钠,发生复分解反应,生成的Fe(OH)2,在空气中逐渐被氧化为Fe(OH)3,现象为生成的白色沉淀迅速变成灰绿色,最后变成红褐色;答案为:3Fe+4H2O(g)
Fe3O4+4H2;反应④为FeCl3与Fe反应,离子方程式为Fe+2Fe3+=3Fe2+;FeCl3中加入氢氧化钠,发生复分解反应,生成的Fe(OH)2,在空气中逐渐被氧化为Fe(OH)3,现象为生成的白色沉淀迅速变成灰绿色,最后变成红褐色;答案为:3Fe+4H2O(g)![]() Fe3O4+4H2;Fe+2Fe3+=3Fe2+;生成的白色沉淀迅速变成灰绿色,最后变成红褐色;
Fe3O4+4H2;Fe+2Fe3+=3Fe2+;生成的白色沉淀迅速变成灰绿色,最后变成红褐色;
(3)由分析知,A为Si,B为SiO2,C为Na2SiO3,D为Na2CO3;反应③为SiO2与NaOH溶液反应,化学方程式为SiO+2NaOH=Na2SiO3+H2O;反应⑤为SiO2与Na2CO3反应,化学方程式为SiO2+Na2CO3![]() Na2SiO3+CO2↑;答案为:SiO2+2NaOH=Na2SiO3+H2O;SiO2+Na2CO3
Na2SiO3+CO2↑;答案为:SiO2+2NaOH=Na2SiO3+H2O;SiO2+Na2CO3![]() Na2SiO3+CO2↑。
Na2SiO3+CO2↑。

【题目】氨在工农业生产中应用广泛。在压强为30MPa时,不同温度时合成氨平衡混合气体中NH3的体积分数如下:
温度/℃ | 200 | 300 | 400 | 500 | 600 |
氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
请回答:
(1)根据图中所示,合成氨的热化学方程式为___。
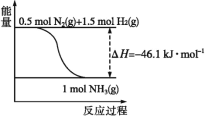
(2)将1molN2(g)和3molH2(g)通入一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量___92.2kJ(填“大于”“等于”或“小于”),原因是___;若加入催化剂,ΔH___(填“变大”“变小”或“不变”)。
(3)已知破坏1molN≡N键、1molH—H键需要吸收的能量分别为946kJ、436kJ,则破坏1molN—H键需要吸收的能量为___kJ。
(4)N2H4可视为NH3分子中的一个H被—NH2取代的产物。发射卫星用N2H4(g)为燃料,以NO2为氧化剂发生反应生成N2和H2O(g)。
已知:N2(g)+2O2(g)=2NO2(g) ΔH1=+67.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH2=-534kJ·mol-1。
则1molN2H4与NO2完全反应的热化学方程式为___。
【题目】四种短周期元素在周期表中的相对位置如图所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。请回答下列问题:
X | Y | |
Z | W |
(1)元素Z位于周期表中第____周期____族。
(2)X、Y元素氢化物稳定性强弱顺序是____(用化学式表示)。
(3)Y、Z的最高价氧化物对应水化物的酸性强弱顺序是____(用化学式表示)。
(4)原子序数比Y多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是____ 。