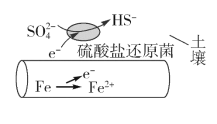
题目内容
【题目】四种短周期元素在周期表中的相对位置如图所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。请回答下列问题:
X | Y | |
Z | W |
(1)元素Z位于周期表中第____周期____族。
(2)X、Y元素氢化物稳定性强弱顺序是____(用化学式表示)。
(3)Y、Z的最高价氧化物对应水化物的酸性强弱顺序是____(用化学式表示)。
(4)原子序数比Y多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是____ 。
【答案】三 ⅤA NH3>CH4 HNO3>H3PO4 2H2O2![]() 2H2O+O2↑(或其他合理答案)
2H2O+O2↑(或其他合理答案)
【解析】
根据四种短周期元素在周期表中的相对位置关系图,X、Y为第二周期元素,Z、W为第三周期元素。短周期元素,Z元素原子的核外电子总数是其最外层电子数的3倍,设最外层为x,则(2+8+x)=3x,解得x=5,则Z为P,则X为C,Y为N,W为S,据此分析解答。
根据上述分析,Z为P,X为C,Y为N,W为S。
(1)Z为P,原子结构中有3个电子层,最外层电子数为5,则位于元素周期表中的第三周期,第VA族,故答案为:三;VA;
(2)同一周期从左向右,非金属性增强,对应氢化物的稳定性增强,非金属性C<N,则氢化物稳定性强弱顺序是NH3>CH4,故答案为:NH3>CH4;
(3) 同一周期从左向右,非金属性增强,则最高价含氧酸的酸性增强,非金属性N>P,最高价氧化物对应水化物的酸性强弱顺序是HNO3>H3PO4,故答案为:HNO3>H3PO4;
(4)原子序数比Y多1的元素是O,O元素一种氢化物能分解为它的另一种氢化物,为过氧化氢的分解,反应的化学方程式为2H2O2![]() 2H2O+O2↑,故答案为:2H2O2
2H2O+O2↑,故答案为:2H2O2![]() 2H2O+O2↑。
2H2O+O2↑。

练习册系列答案
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案
相关题目