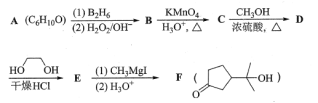
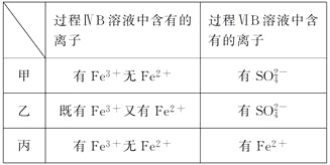
题目内容
【题目】将200mL CuSO4和Fe2(SO4)3的混合溶液分成两等份,向其中一份加入足量铁粉,充分反应后测得固体质量保持不变;向另一份中加入足量BaCl2溶液,经过滤、洗涤、干燥、称量,得到23.3g白色沉淀。请计算:
(1)原溶液中c(SO42-) = __________。
(2)原溶液中CuSO4和Fe2(SO4)3的物质的量比为__________。
【答案】1.00 mol/L 7:1
【解析】
(1)每一份溶液体积为100mL,由SO42-+Ba2+=BaSO4↓可知:n(SO42-)=n(BaSO4),根据c=![]() 计算硫酸根离子浓度。
计算硫酸根离子浓度。
(2)Fe+Cu2+=Fe2++Cu使固体的质量增加而2Fe3++Fe=3Fe2+使固体质量减小,固体质量保持不变,说明前者增加量等于后者减少量。
(1)根据上述每份溶液的体积为100mL,每份溶液中n(SO42-)=n(BaSO4)=![]() =0.1mol,则原溶液中c(SO42-)=
=0.1mol,则原溶液中c(SO42-)=![]() ,故答案为:1.00 mol/L。
,故答案为:1.00 mol/L。
(2)设生成Cu的质量为64g,则Fe+Cu2+=Fe2++Cu,使固体增重64g-56g=8g,则2Fe3++Fe=3Fe2+中参加反应的Fe为8g,由方程式可知,n(Cu2+)=nCu)=![]() =1mol,n(Fe3+)=2
=1mol,n(Fe3+)=2![]() =
=![]() ,故CuSO4和Fe2(SO4)2的物质的量比为1mol:(
,故CuSO4和Fe2(SO4)2的物质的量比为1mol:(![]() )=7:1,故答案为:7:1。
)=7:1,故答案为:7:1。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目