题目内容
【题目】煤、氢气是常见能源,燃煤烟气中的氮硫氧化物要污染环境,氢气是一种清洁高效的新型能源,如何消除烟气中氮硫氧化物和经济实用的制取氢气成为重要课题。
(1)硫碘循环分解水是一种高效、环保的制氢方法,其流程图如图。
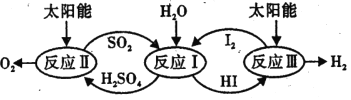
已知:
反应 I:2H2O (1)=2 H2(g) +O2(g) △H1 = +572kJmol-1
反应 II :H2SO4(aq) =SO2 (g) + H2O (l) +![]() O2 ( g) △H2= +327 kJ mol-1
O2 ( g) △H2= +327 kJ mol-1
反应 III:2 HI( aq)=H2 ( g) + I2(g) △H3 =+172k.Jmol-1
则反应SO2 (g)+I2 (g) + 2 H2O (l)=2 HI(aq) + H2SO4 (aq) △H =__________。
(2)用某氢化物 H2 R 高效制取氢气 ,发生的反应为2 H2R(g) ![]() R2(g) +2H2 ( g) 。
R2(g) +2H2 ( g) 。
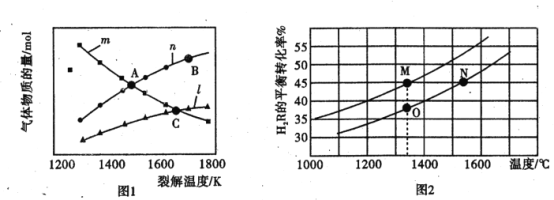
I.若起始时容器中只有H2R, 平衡时三种物质的物质的量与裂解温度的关系如图1。
①图中曲线n 表示的物质是__________(填化学式)。
②C点时,设容器内的总压为p Pa,则平衡常数KP =____________ (用平衡分压代替平衡浓度计算,分压 =总压×物质的量分数)。
II.若在两个等体积的恒容容器中分别加入2.0 mol H 2R、1. 0 molH2R,测得不同温度H2R的平衡转化率如图2 所示。
①M点和O正反应速率v( M) ________v( O) (填“>”“<”或“=”,下同)。
②M 、O 两点容器内的压强P(O)______2 P( M) 。
③平衡常数K( M)_____________K( N)。
(3)以连二硫酸根( S2O42-) 为媒介,使用间接电化学法处理燃煤烟气中的NO, 装置如图所示:
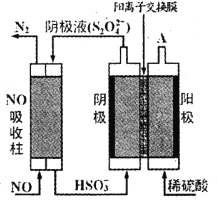
①从 A 口中出来的物质是________________。
②写出电解池阴极的电极反应式________________。
③用离子方程式表示吸收池中除去NO 的原理 ___________________________。
【答案】- 785kJmol-1 H2 p Pa < < < O2(或氧气)和较浓的硫酸 2HSO3-+ 2H ++ 2e –=S2O42-+ 2H2O 2NO +2S2O42-+ 2H2O=N2+ 4 HSO3-
【解析】
(1)利用盖斯定律进行计算反应SO2(g)+I2(g) + 2 H2O (l)=2 HI(aq) + H2SO4(aq)的△H;
(2) I .由反应方程式2H2R(g)![]() R2(g) +2H2 ( g)可 知,若起始时容器中只有H2R,平衡时R2的物质的量为H2的
R2(g) +2H2 ( g)可 知,若起始时容器中只有H2R,平衡时R2的物质的量为H2的![]() ,则曲线l表示的物质是R2, 曲线m表示的物质是H2R, 曲线n表示的物质是H2,据此分析解答;
,则曲线l表示的物质是R2, 曲线m表示的物质是H2R, 曲线n表示的物质是H2,据此分析解答;
II.反应2H2R(g)![]() R2(g) +2H2 ( g)中,H2R的物质的量增加,其平衡转化率反而减小,即M.点和O点分别所在的曲线代表H2R的起始量为2.0mol和1.0mol,据此解答;
R2(g) +2H2 ( g)中,H2R的物质的量增加,其平衡转化率反而减小,即M.点和O点分别所在的曲线代表H2R的起始量为2.0mol和1.0mol,据此解答;
(3)根据电池原理进行分析解答。
(1)根据盖斯定律,由-I![]() - II -Ⅲ得反应SO2(g)+I2(g) + 2 H2O (l)=2 HI(aq) + H2SO4(aq)△H=- 785kJmol-1;
- II -Ⅲ得反应SO2(g)+I2(g) + 2 H2O (l)=2 HI(aq) + H2SO4(aq)△H=- 785kJmol-1;
(2)I .①由反应方程式2H2R(g)![]() R2(g) +2H2 ( g)可知, 若起始时容器中只有H2R,平衡时R2的物质的量为H2的
R2(g) +2H2 ( g)可知, 若起始时容器中只有H2R,平衡时R2的物质的量为H2的![]() ,则曲线n 表示的物质是H2;
,则曲线n 表示的物质是H2;
②根据A点可知,起始时硫化氢为20mol,B点时,H2R与R2的物质的量相等,设分解的H2R为x,则20-x=![]() ,解得x=
,解得x=![]() mol,容器中含有H2R
mol,容器中含有H2R![]() mol,R2
mol,R2![]() mol,H2
mol,H2![]() mol,物质的量分数分别为
mol,物质的量分数分别为![]() ,
,![]() ,
,![]() ,平衡常数Kp=
,平衡常数Kp=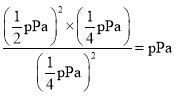 ;
;
II.①反应![]() R2(g) +2H2 ( g)中,H2R的物质的量增加,其平衡转化率反而减小,即M点和O点分别所在的曲线代表H2R的起始量为2.0mol和1.0mol, 恒容容器中,M点的浓度小于0点,则逆反应速率v(M)< v(O);
R2(g) +2H2 ( g)中,H2R的物质的量增加,其平衡转化率反而减小,即M点和O点分别所在的曲线代表H2R的起始量为2.0mol和1.0mol, 恒容容器中,M点的浓度小于0点,则逆反应速率v(M)< v(O);
②由图像可知,H2R的转化率分别为45%和37.5%,可列三段式有:

n(总)M=1.1+0.45+0.9=2.45mol,

n(总)O=0.25+0.375+0.75=1.375mol,2n(总)O=2.75 mol >n(总)M=2.45mol,又图像可知TM=TO,由PV=nRT可得,P(O)<2 P( M);
③由图中曲线可知,升高温度H2R的转化率增大,平衡正向移动,K值增大,则正反应为吸热反应,因T( M)< T( N),故平衡常数K( M)< K( N);
(3)①阳极电解质溶液为稀H2SO4,在阳极,溶液中水电离产生的OH-失去电子发生氧化反应,电极反应式为: 2H2O-2e-=O2↑+4H+,由于水不断放电消耗,所以阳极区H2SO4溶液浓度不断增大,所以从A口中出来的物质的是O2和较浓的硫酸;
②在电解池阴极上得到电子发生还原反应,根据图可知是HSO3-在酸性条件下发生还原反应,生成S2O42-,其电极反应式为2HSO3-+2e-+2H+=S2O42-+2H2O;
③根据图示,吸收池中S2O42-和NO是反应物,N2和HSO3-是生成物,则根据电子守恒、电荷守恒、原子守恒,可得吸收池中除去NO的原理是2NO +2S2O42-+ 2H2O=N2+ 4 HSO3-。

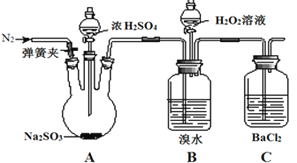
【题目】为探究H2O2、SO2、Br2的性质,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。
实验操作 | 实验现象 |
i.打开弹簧夹,通入N2一段时间,关闭弹簧夹,打开A中分液漏斗活塞,滴加浓硫酸 | A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀 |
ⅱ.取C中沉淀加入盐酸 | C中白色沉淀不溶解 |
ⅲ.打开B中分液漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
(1)在滴入浓硫酸之前要通入N2一段时间的目的是__________________________。
(2)该实验可以证明SO2具有_________性;H2O2的氧化性_________Br2(填“强于”“弱于”)。
(3)B中红棕色褪去的原因_______________________________,B中重新变成红棕色的原因____________________________________(均用离子方程式表示)。
(4)C中产生的白色沉淀是______。
(5)甲同学通过C中产生白色沉淀,得出结论:SO2能与BaCl2反应产生沉淀。乙同学认为不能得出此结论,并对实验进行了改进:在B和C之间增加盛放_________的洗气瓶。再次进行实验时,则C中未产生沉淀。
(6)为进一步研究SO2的性质,分别用煮沸和未煮沸过的蒸馏水配制Ba(NO3)2和BaCl2溶液,进行如下实验:
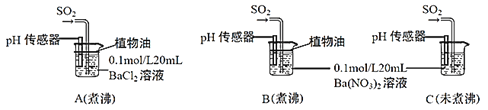
①实验A中,没有观察到白色沉淀,但pH传感器显示溶液呈酸性,原因是__________________。(用化学方程式表示)
②实验C中出现白色沉淀比实验B快很多。由此得出的结论是__________________。若实验B、C中通入足量的SO2后,溶液酸性:B_________C(填“强于”“弱于”“等于”)。
(7)Na2SO3固体因贮放不慎发生变质。现取样品1.8克溶于水得溶液A,在A中加入足量BaCl2溶液,过滤得沉淀B,将沉淀B加入足量的稀硫酸后,沉淀不仅不消失,反而增加了0.16g(假如沉淀完全转化)。样品中Na2SO3的质量分数是___________________。
【题目】铅酸蓄电池价格低廉,原材料易得,适用范围广。其放电时的反应原理为:
Pb+PbO2+2H2SO4===2PbSO4+2H2O。

(1) 写出铅酸蓄电池放电时正极的电极反应式:________,放电时,H+向电池______极定向移动(填“正”或“负”)。
(2) 传统的铅酸蓄电池在充电末期,电极上会产生O2,为了避免气体逸出形成酸雾腐蚀设备,科学家发明了密封铅蓄电池(VRLA),采用阴极吸收法达到密封效果。其原理如图所示,则O2在阴极被吸收的电极反应式为________。
(3) 铅的电解精炼是工业上实现废铅回收以及粗铅提纯的重要手段。铅的电解精炼在由PbSiF6和H2SiF6两种强电解质组成的水溶液中进行。从还原炉中产出的某粗铅成分如下表所示:
成分 | Pb | Cu | Ag | Fe | Zn | Sn | 其它 |
% | 97.50 | 1.22 | 0.12 | 0.15 | 0.09 | 0.64 | 0.28 |
①电解精炼时阳极泥的主要成分是________(元素符号)。
②电解后阴极得到的铅中仍含有微量的杂质,该杂质最有可能是________(填一种)。
③电解过程中,粗铅表面会生成SiF6气体,写出该电极反应式________。