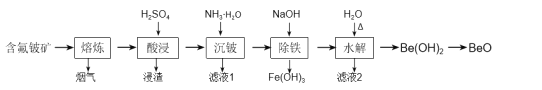
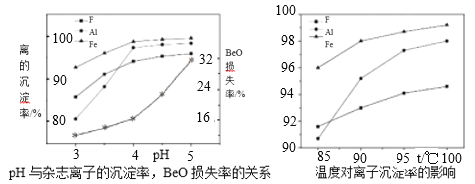
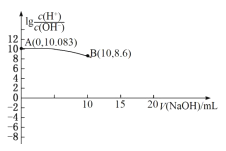
题目内容
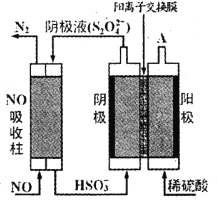
【题目】某研究团队在优化催化剂的基础上,通过调节电极的孔道和疏水性增加CO的扩散速率,实现了高选择性将CO电解还原制备乙烯,如图所示。下列叙述错误的是( )
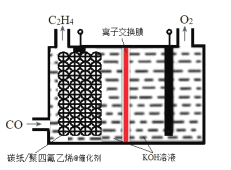
A.碳纸/聚四氟乙烯电极为阴极
B.聚四氟乙烯的作用是吸附并增加CO的浓度
C.为了维持电解的效率,离子交换膜应为阳离子交换膜
D.碳纸上生成C2H4的电极反应式为:2CO+6H2O+8e-=C2H4+8OH-
【答案】C
【解析】
A.根据装置示意图可知,CO在碳纸/聚四氟乙烯电极反应生成C2H4,碳元素化合价降低,得电子发生还原反应,则碳纸/聚四氟乙烯电极为阴极,A正确;
B.碳纸/聚四氟乙烯电极@催化剂为阴极,碳纸的作用为增强电极的导电性,聚四氟乙烯可以吸附CO,提高其在氢氧化钾溶液中的浓度,增大CO与催化剂的接触面积,B正确;
C.阴极反应生成氢氧根离子,阳极反应消耗氢氧根离子,电极反应式为4OH--4e-=2H2O+O2↑,为了维持电解质溶液导电能力的稳定,故离子交换膜应为阴离子交换膜,C错误;
D.电解质溶液呈碱性,CO在碳纸/聚四氟乙烯电极得电子生成C2H4和氢氧根离子,电极反应式为2CO+6H2O+8e-=C2H4+8OH-,D正确;
答案选C。

【题目】汽车尾气净化器中发生的反应为2NO(g)+2CO(g)![]() N2(g)+2 CO2(g)。一定温度下, 在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
N2(g)+2 CO2(g)。一定温度下, 在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
容器 | 温度/(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | ||||
NO | CO | N2 | CO2 | N2 | CO2 | ||
I | 400 | 0.2 | 0.2 | 0 | 0 | 0.12 | |
II | 400 | 0.4 | 0.4 | 0 | 0 | ||
III | 300 | 0 | 0 | 0.1 | 0.2 | 0.075 | |
下列说法正确是
A. 该反应的ΔS<0、ΔH<0
B. 容器I中达到平衡所需时间2s,则v(N2)=0.06 molL-1·S-1
C. 达到平衡时,体系中c(CO)关系:c(CO,容器II)>2c(CO,容器I)
D. 若起始时向I中充入NO、CO、N2、CO2各0.1mol,开始时V正>V逆
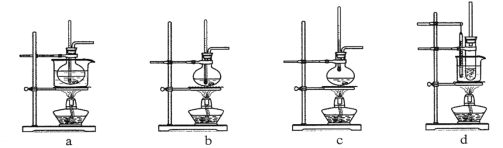
【题目】某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。

(1)试剂X的化学式________。A中制取Cl2的离子方程式____________________。
(2)试剂Y的名称为______________。
(3)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中除含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和____________________________;
假设2:存在三种成分:NaHCO3和__________________________。
②设计方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
实验步骤 | 预期现象和结论 |
步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中 | |
步骤2:向A试管中滴加BaCl2溶液 | __________________ |
步骤3:______________ | __________________ |
(4)已知Cl2O与水反应生成次氯酸,则D中Cl2O进入E反应的化学方程式为____________。