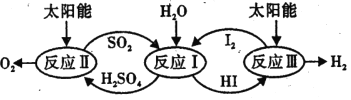
题目内容
【题目】亚硝酰氯( NOCl) 是有机合成中的重要试剂,为黄色气体或红褐色液体(熔点- 64. 5℃,沸点-5.5℃),具有刺鼻恶臭味,遇水和潮气水解,有多种方法制备。
(1)方法一:将5 g 经300℃下干燥了 3h 并研细的 KCl 粉末装入 50 mL 带有接头及抽真空用活塞的玻璃容器内。将容器尽量减压,在减压下通入0. 002 mol NO2。反应 12 ~ 36 min 即可完成,NO2红棕色消失 ,出现黄色亚硝酰氯,同时还得到一种盐。写出亚硝酰氯的电子式________,该方法制备NOCl的化学方程式为_________________,氯化钾需要“干燥”的原因是_______________。
(2)方法二:实验室可用如图装置制备亚硝酰氯(NOCl),检验装置气密性并装入药品打开 K2,然后再打开___________(填“K1 ”或"“K3 ”) 通入一段时间气体,其目的为______,然后进行其他操作,当 Z 有一定量液体生成时,停止实验。写出X 装置中反应的离子方程式_____________________ 。

(3)测定产品纯度:取(2)中w g Z 中液态产品溶于蒸馏水,配制成250 ml 溶液;用酸式滴定管准确量取25. 00mL 所配溶液于锥形瓶中,滴加几滴 K2CrO4溶液作指示剂,用滴定管盛装 c mol·L-1 AgNO3标准溶液滴定至终点,消耗标准溶液体积为V mL。[已知:Ksp( AgCl ) =1.56 ×10-10 ,Ksp(Ag2CrO4)=1×10-12,Ag2CrO4为砖红色固体,忽略杂质参与反应]
①盛装AgNO3 标准溶液的滴定管是____(填“酸式”或“碱式”)棕色滴定管;判断达到滴定终点的方法是_____________________。
②该产品纯度为_____________(用代数式表示)。
【答案】![]() 2NO2+ KCl =KNO3+ NOCl NOCl 遇水易水解,NO2与水反应 K3 排尽三颈烧瓶中的空气,防止一氧化氮被氧化,防止产品( NOCl) 变质 3Cu ++ 8H++2NO3- == 2NO↑+ 4H2O+ 3Cu2+ 酸式 溶液中恰好出现砖红色沉淀且半分钟内不消失
2NO2+ KCl =KNO3+ NOCl NOCl 遇水易水解,NO2与水反应 K3 排尽三颈烧瓶中的空气,防止一氧化氮被氧化,防止产品( NOCl) 变质 3Cu ++ 8H++2NO3- == 2NO↑+ 4H2O+ 3Cu2+ 酸式 溶液中恰好出现砖红色沉淀且半分钟内不消失 ![]() 或
或![]()
【解析】
在玻璃容器内,NO2与KCl发生反应,生成NOCl和KNO3,由于NOCl和NO2都能与水发生反应,所以整个容器内应保持无水环境。实验室用如图装置制备亚硝酰氯(NOCl),此反应在装置Z中进行,发生反应为2NO+Cl2==2NOCl,装置X为制取NO的装置,铜丝与稀硝酸反应生成硝酸铜、一氧化氮等;装置Y为NO的干燥装置。由于NOCl易发生水解且NO易被空气中的O2氧化,所以反应需在无水、无氧环境中进行,也就是在Z中通入NO前需排尽装置内的空气。计算产品的纯度时,Ag+与Cl-发生反应生成AgCl,由Ksp( AgCl ) =1.56 ×10-10可以看出,Cl-可完全转化为沉淀,由AgNO3的用量可计算出溶液中n(Cl-),由此计算产品中所含NOCl的质量及纯度。
(1)亚硝酰氯的化学式为NOCl,由于N、O、Cl分别需要形成3、2、1对共用电子,所以在电子式中,N应位于O、Cl原子的中间,从而得出亚硝酰氯的电子式为![]() ;由分析知,NO2与KCl反应生成NOCl,同时还得到一种盐,此盐只能为KNO3,所以该方法制备NOCl的化学方程式为2NO2+ KCl ==KNO3+ NOCl;由于NOCl和NO2都能与水发生反应,所以氯化钾需要“干燥”的原因是NOCl 遇水易水解,NO2与水反应。答案为:
;由分析知,NO2与KCl反应生成NOCl,同时还得到一种盐,此盐只能为KNO3,所以该方法制备NOCl的化学方程式为2NO2+ KCl ==KNO3+ NOCl;由于NOCl和NO2都能与水发生反应,所以氯化钾需要“干燥”的原因是NOCl 遇水易水解,NO2与水反应。答案为:![]() ;2NO2+ KCl ==KNO3+ NOCl;NOCl 遇水易水解,NO2与水反应;
;2NO2+ KCl ==KNO3+ NOCl;NOCl 遇水易水解,NO2与水反应;
(2)实验室用如图装置制备亚硝酰氯(NOCl),检验装置气密性并装入药品打开K2。由于NO与Cl2接触后就会发生反应生成易水解的NOCl,且NO能被空气中的O2氧化,所以通入NO前,需排尽装置Z内的空气,因此打开K3通入一段时间气体,其目的为排尽三颈烧瓶中的空气,防止一氧化氮被氧化,防止产品( NOCl) 变质。X 装置中,铜丝与稀硝酸反应生成硝酸铜、一氧化氮气体和水,反应的离子方程式为3Cu ++ 8H++2NO3- == 2NO↑+ 4H2O+ 3Cu2+。答案为:K3;排尽三颈烧瓶中的空气,防止一氧化氮被氧化,防止产品( NOCl) 变质;3Cu ++ 8H++2NO3- == 2NO↑+ 4H2O+ 3Cu2+;
(3)①因为AgNO3标准溶液会腐蚀橡皮管,且见光易分解,所以盛装AgNO3标准溶液的滴定管是酸式棕色滴定管;滴定终点时,生成的Ag2CrO4为砖红色固体,所以判断达到滴定终点的方法是溶液中恰好出现砖红色沉淀且半分钟内不消失。
②Z 中液态产品溶于蒸馏水,与水反应生成HNO2和HCl,滴加AgNO3溶液,发生反应Ag++Cl-==AgCl↓,25. 00mL 所配溶液中,n(NOCl)=n(Cl-)=n(AgNO3)= cmol·L-1×V ×10-3L= cV ×10-3mol,该产品纯度为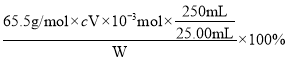 =
=![]() 或
或![]() 。答案为:酸式;溶液中恰好出现砖红色沉淀且半分钟内不消失;
。答案为:酸式;溶液中恰好出现砖红色沉淀且半分钟内不消失;![]() 或
或![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】汽车尾气净化器中发生的反应为2NO(g)+2CO(g)![]() N2(g)+2 CO2(g)。一定温度下, 在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
N2(g)+2 CO2(g)。一定温度下, 在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
容器 | 温度/(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | ||||
NO | CO | N2 | CO2 | N2 | CO2 | ||
I | 400 | 0.2 | 0.2 | 0 | 0 | 0.12 | |
II | 400 | 0.4 | 0.4 | 0 | 0 | ||
III | 300 | 0 | 0 | 0.1 | 0.2 | 0.075 | |
下列说法正确是
A. 该反应的ΔS<0、ΔH<0
B. 容器I中达到平衡所需时间2s,则v(N2)=0.06 molL-1·S-1
C. 达到平衡时,体系中c(CO)关系:c(CO,容器II)>2c(CO,容器I)
D. 若起始时向I中充入NO、CO、N2、CO2各0.1mol,开始时V正>V逆