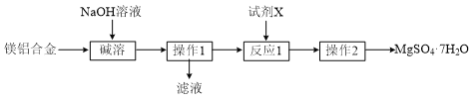
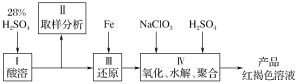
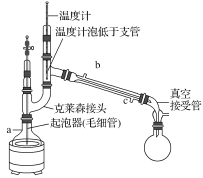
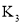题目内容
【题目】完成下列填空:
(1)与标准状况下4.48LCO2中所含氧原子数目相同的水的质量是__g;
(2)VLFe2(SO4)3溶液中含Fe3+mg,则溶液中SO42-的物质的量浓度为__mol/L;
(3)氧化铜在高温下发生分解反应:4CuO![]() 2Cu2O+O2↑,若反应过程中生成1molO2分子,则转移电子数为__。(阿伏伽德罗常数为NA)。
2Cu2O+O2↑,若反应过程中生成1molO2分子,则转移电子数为__。(阿伏伽德罗常数为NA)。
(4)在Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O的反应中,HNO3表现了__性和__性,则56gFe参加反应时,被还原的HNO3为__g。
【答案】7.2 ![]() 4NA 氧化 酸性 63
4NA 氧化 酸性 63
【解析】
(1)标准状况下4.48LCO2的物质的量为![]() =0.2mol,题干要求CO2与H2O含有O原子数目相等,则n(H2O)=2n(CO2)=0.4mol,水的质量为0.4mol×18g/mol=7.2g,故答案为:7.2g;
=0.2mol,题干要求CO2与H2O含有O原子数目相等,则n(H2O)=2n(CO2)=0.4mol,水的质量为0.4mol×18g/mol=7.2g,故答案为:7.2g;
(2)Fe3+的物质的量为![]() =
=![]() mol,根据Fe2(SO4)3的化学式可知:n(SO42-)=
mol,根据Fe2(SO4)3的化学式可知:n(SO42-)= ![]() n(Fe3+)=
n(Fe3+)=![]() ×
×![]() mol =
mol =![]() mol,则溶液中SO42-的物质的量浓度为c(SO42-) =
mol,则溶液中SO42-的物质的量浓度为c(SO42-) =![]() =
=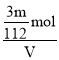 =
=![]() mol,故答案为:
mol,故答案为:![]() ;
;
(3)根据反应方程式中氧元素的化合价从-2价升高到0价可知,一个氧原子化合价升高两价,转移两个电子,一个氧气分子化合价升高4价,转移4个电子,1molO2分子,则转移电子数为4mol,即4NA,故答案为:4NA;
(4)在Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O的反应中,4mol硝酸有1mol变价,3mol不变价,变价的起氧化性作用将铁氧化,不变价的与铁离子结合成盐起酸性作用;56g的铁的物质的量为![]() =1mol,根据1mol铁被氧化有1mol硝酸被还原,所以被还原的硝酸的质量为1mol×63g/mol=63g,故答案为:氧化;酸性;63。
=1mol,根据1mol铁被氧化有1mol硝酸被还原,所以被还原的硝酸的质量为1mol×63g/mol=63g,故答案为:氧化;酸性;63。

【题目】一定温度下,在三个容积均为2L的恒容密闭容器中按不同方式投入反应物,发生反应:2CO(g) + 4H2(g)CH3OCH3(g) + H2O(g) △H<0,测得反应的相关数据如下表:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 600 | 600 | 500 |
反应物投入量 | 0.2mol CO 0.4mol H2 | 0.4mol CO 0.8mol H2 | 0.2mol CH3OCH3 0.2mol H2O |
平衡v(CO)/(mol·L-1·s-1) | v1 | v2 | v3 |
平衡n(H2)/(mol) | 0.2 | n2 | n3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率a | a1(CO) | a2(CO) | a3(CH3OCH3) |
平衡常数K | K1 | K2 | K3 |
下列说法正确的是
A.v1<v2,n2>0.4B.K2=2.5×103,p2>p3
C.2p1<p3,a1(CO) >a2(CO)D.n3<0.4,a2(CO) + a3(CH3OCH3)<1
【题目】已知K2Cr2O7溶液中存在平衡:![]() +H2O
+H2O![]() 2
2![]() +2H+。K2Cr2O7为橙色,K 2CrO4为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
+2H+。K2Cr2O7为橙色,K 2CrO4为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
5mL0.1mol/LK2Cr2O7溶液 | 序号 | 试剂X |
ⅰ | 1mL1mol·L-1 K2Cr2O7 溶液 | |
ⅱ | 1mL1 mol·L-1 K2CrO4溶液 | |
ⅲ | 5~15滴浓硫酸 | |
ⅳ | 5~15滴浓盐酸 | |
ⅴ | 5~15滴6 mol·L-1 NaOH溶液 |
Ⅰ.方案讨论
(1)ⅰ~ⅴ中依据减少生成物浓度可导致平衡移动的原理设计的是_____(填序号)。
(2)已知BaCrO4为黄色沉淀。某同学认为试剂X还可设计为Ba(NO3)2溶液,加入该试剂后,溶液颜色将_____。(填“变深”、“变浅”或“不变”)。
Ⅱ.实验分析
序号 | 试剂X | 预期现象 | 实际现象 |
ⅰ | 1 mL1 mol·L-1 K2Cr2O7 溶液 | 溶液变黄 | 溶液橙色加深 |
ⅱ | 1mL1 mol·L-1 K2CrO | 溶液橙色加深 | 溶液颜色变浅 |
ⅲ | 5~15滴浓硫酸 | 溶液橙色加深 | 溶液橙色加深 |
ⅳ | 5~15滴浓盐酸 | 溶液橙色加深 | 无明显现象 |
ⅴ | 5~15滴6mol·L-1NaOH溶液 | 溶液变黄 | 溶液变黄 |
(1)实验ⅰ没有观察到预期现象的原因是_____,实验ⅱ的原因与其相似。
(2)通过实验ⅲ和ⅴ得出的结论为_____。
(3)实验ⅳ无明显现象,可能的原因是____________。
(4)某同学查阅资料发现:K2Cr2O7溶液与浓盐酸可发生氧化还原反应。但实验ⅳ中没有观察到明显现象,小组同学设计了下实验,验证了该反应的发生。
方案:取5 mL浓盐酸,向其中加入15滴0.1mol·L-1 K2Cr2O7溶液,一段时间后,溶液变为绿色(CrCl3水溶液呈绿色),有黄绿色气体生成。写出该变化的化学方程式______。