题目内容
【题目】三氯氧磷(POCl3)常用作有机合成的氯化剂、催化剂和阻燃剂等。POCl3遇水会强烈水解,生成H3PO4和HCl。为测定某POCl3样品中Cl元素含量,进行下列实验:
①准确称取30.70 g POCl3样品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解;
②将水解液配成100.00 mL溶液A,取10.00 mL溶液A于锥形瓶中;
③加入10.00 mL 3.200 mol·L-1 AgNO3标准溶液,并加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖;
④加入指示剂,用0.200 0 mol·L-1 KSCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00 mL KSCN溶液。
已知:AgSCN是白色沉淀,Ksp(AgSCN)=2×10-12,Ksp(AgCl)=1.8×10-10。
(1) 滴定选用的指示剂是________ (填字母);滴定终点的现象为________。
A. FeCl2 B. NH4Fe(SO4)2 C. 淀粉 D. 甲基橙
(2) 用硝基苯覆盖沉淀的目的是________;若无此操作,所测Cl元素含量将会________ (填“偏大”、“偏小”或“不变”)。
(3) 计算三氯氧磷样品中Cl元素的含量________ (写出计算过程)。
【答案】B 当最后一滴标准KSCN溶液滴入时,溶液变为血红色,且半分钟不褪去 使生成的沉淀与溶液隔离,避免滴定过程中SCN-与AgCl反应(或防止沉淀转化生成AgSCN而导致数据不准确) 偏小 先后发生的反应:POCl3+3H2O=H3PO4+3HCl、Cl-+Ag+=AgCl↓、SCN-+Ag+=AgSCN↓;
n(AgNO3)总=3.200 mol·L-1×10.00×10-3 L=3.200×10-2 mol;
n(Ag+)剩余=n(SCN-)=0.200 0 mol·L-1×10.00×10-3 L=2.000×10-3 mol;
与Cl-反应的n(Ag+)=n(AgNO3)总-n(Ag+)剩余=0.030 mol;
m(Cl元素)=0.030 mol×35.5 mol·L-1=1.065 g;
w(Cl元素)=![]() ×100%=34.69%。
×100%=34.69%。
【解析】
该滴定原理为:先将POCl3样品彻底水解,氯元素全部以Cl-形式存在,取样,然后加入硝酸银标准液,将银离子沉淀,然后再滴加KSCN标准液,测定剩余银离子的量,从而确定氯离子消耗的银离子的量,得到氯离子的量;加入硝酸银时加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖,以防用KSCN溶液滴定剩余硝酸银时氯化银转化为AgSCN,使滴定结果不准。
(1)滴定终点时,KSCN过量,所以选用的指示剂应能和SCN-反应使溶液变色,Fe3+与SCN-反应溶液变红色,所以选NH4Fe(SO4)2为指示剂,滴定终点,可观察到最后一滴标准液KSCN溶液滴入时,溶液变为血红色,且半分钟不褪去;
(2)根据题目信息可知AgSCN沉淀的溶解度比AgCl小,KSCN溶液直接与氯化银接触会发生沉淀转化,导致滴定结果不准确;加入硝基苯用力摇动,使AgCl沉淀表面被有机物覆盖,使生成的沉淀与溶液隔离,避免滴定过程中SCN-与AgCl反应(或防止沉淀转化生成AgSCN而导致数据不准确);如果不进行此操作,消耗的KSCN溶液偏多,根据滴定原理可知会导致样品中氯元素的含量偏小;
(3)先后发生的反应:POCl3+3H2O=H3PO4+3HCl、Cl-+Ag+=AgCl↓、SCN-+Ag+=AgSCN↓;
n(AgNO3)总=3.200 mol·L-1×10.00×10-3 L=3.200×10-2 mol;
n(Ag+)剩余=n(SCN-)=0.200 0 mol·L-1×10.00×10-3 L=2.000×10-3 mol;
与Cl-反应的n(Ag+)=n(AgNO3)总-n(Ag+)剩余=0.030 mol;
m(Cl元素)=0.030 mol×35.5 mol·L-1=1.065 g;
w(Cl元素)=![]() ×100%=34.69%。
×100%=34.69%。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
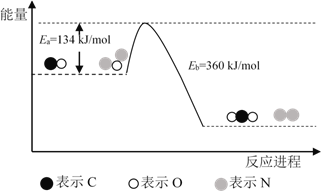
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】已知N2(g)+3H2(g)![]() 2NH3(g) △H=92.4 kJ·mol-1,在温度相同、容积均为2 L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是
2NH3(g) △H=92.4 kJ·mol-1,在温度相同、容积均为2 L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol N2、3 mol H2 | 2 mol N2、6 mol H2 | 2 mol NH3 |
NH3的浓度(mol·L-1) | c1 | c2 | c3 |
反应的能量变化 | 放出Q1kJ | 放出Q2kJ | 吸收Q3kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
A.Q3+92.4c1=92.4B.α2+α3<1
C.2p1=2p3<p2D.达到平衡时丙容器中NH3的体积分数最大
【题目】化学反应伴随能量变化,获取反应能量变化有多条途径。
(1)下列反应中,属于吸热反应的是______(填字母)。
A.Na2O与水反应 B.甲烷的燃烧反应C.CaCO3受热分解 D.锌与盐酸反应
(2)获取能量变化的途径① 通过化学键的键能计算。已知:
化学键种类 | H—H | O=O | O—H |
键能(kJ/mol) | 436 | 498 | 463.4 |
计算可得:2H2(g)+ O2(g) =2H2O(g) H=____________kJ·mol-1
②通过盖斯定律可计算。已知在25℃、101kPa时:
Ⅰ.2Na(s)+![]() O2(g) =Na2O(s)△H=-414kJ·mol-1
O2(g) =Na2O(s)△H=-414kJ·mol-1
Ⅱ.2Na(s)+O2(g) =Na2O2(s)△H=-511kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式__________。
③ 利用实验装置测量。测量盐酸与NaOH溶液反应的热量变化的过程中,若取50 mL 0.50 mol·L-1的盐酸,则还需加入________(填序号)。
A.50 mL 0.50 mol·L-1NaOH溶液B.50 mL 0.55 mol·L-1NaOH溶液 C.1.0 g NaOH固体