题目内容
【题目】由镁铝合金制取MgSO4·7H2O的工艺流程如下图:
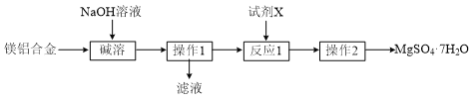
(1)“碱溶”的离子方程式为_______。
(2)“操作1”的名称为_______。
(3)试剂X的名称为_______。
(4)“操作2”含“加热浓缩、降温结晶、过滤、乙醇洗涤、干燥”,用乙醇洗涤的目的是______。
【答案】![]() 过滤 硫酸溶液 减少MgSO4 ·7H2O的溶解损失,利于后续的干燥(答出一点即可)
过滤 硫酸溶液 减少MgSO4 ·7H2O的溶解损失,利于后续的干燥(答出一点即可)
【解析】
(1)镁铝合金中镁与NaOH不反应,铝与NaOH反应生成偏铝酸钠和氢气,其反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)操作1得到有“滤液”,故操作1为过滤;
(3)操作1得到的固体为镁单质,由最终制备物质为MgSO4·7H2O可知,加入的试剂X为硫酸溶液;
(4)由MgSO4溶液得到MgSO4·7H2O,经过加热浓缩、降温结晶、过滤后,得到的MgSO4·7H2O表面含有硫酸和水,因MgSO4·7H2O易溶于水以及乙醇具有良好的挥发性,所以用乙醇洗涤的目的是减少MgSO4 ·7H2O的溶解损失,利于后续的干燥。

 阅读快车系列答案
阅读快车系列答案【题目】温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应:2NO2(g)![]() 2NO(g)+O2(g)相关数据如下表所示。下列说法错误的是( )
2NO(g)+O2(g)相关数据如下表所示。下列说法错误的是( )
容器 编号 | 物质的起始浓度 (mol·L-1) | 物质的平衡浓度 (mol·L-1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
A. 容器Ⅰ中发生反应的平衡常数为0.8 B. 容器Ⅱ中发生反应的起始阶段有v正>v逆
C. 达到平衡时,容器Ⅲ中![]() >1 D. 达到平衡时,容器Ⅰ与容器Ⅲ中的总压强之比为16∶17
>1 D. 达到平衡时,容器Ⅰ与容器Ⅲ中的总压强之比为16∶17
【题目】已知N2(g)+3H2(g)![]() 2NH3(g) △H=92.4 kJ·mol-1,在温度相同、容积均为2 L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是
2NH3(g) △H=92.4 kJ·mol-1,在温度相同、容积均为2 L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol N2、3 mol H2 | 2 mol N2、6 mol H2 | 2 mol NH3 |
NH3的浓度(mol·L-1) | c1 | c2 | c3 |
反应的能量变化 | 放出Q1kJ | 放出Q2kJ | 吸收Q3kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
A.Q3+92.4c1=92.4B.α2+α3<1
C.2p1=2p3<p2D.达到平衡时丙容器中NH3的体积分数最大