题目内容
【题目】已知K2Cr2O7溶液中存在平衡:![]() +H2O
+H2O![]() 2
2![]() +2H+。K2Cr2O7为橙色,K 2CrO4为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
+2H+。K2Cr2O7为橙色,K 2CrO4为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
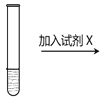
5mL0.1mol/LK2Cr2O7溶液 | 序号 | 试剂X |
ⅰ | 1mL1mol·L-1 K2Cr2O7 溶液 | |
ⅱ | 1mL1 mol·L-1 K2CrO4溶液 | |
ⅲ | 5~15滴浓硫酸 | |
ⅳ | 5~15滴浓盐酸 | |
ⅴ | 5~15滴6 mol·L-1 NaOH溶液 |
Ⅰ.方案讨论
(1)ⅰ~ⅴ中依据减少生成物浓度可导致平衡移动的原理设计的是_____(填序号)。
(2)已知BaCrO4为黄色沉淀。某同学认为试剂X还可设计为Ba(NO3)2溶液,加入该试剂后,溶液颜色将_____。(填“变深”、“变浅”或“不变”)。
Ⅱ.实验分析
序号 | 试剂X | 预期现象 | 实际现象 |
ⅰ | 1 mL1 mol·L-1 K2Cr2O7 溶液 | 溶液变黄 | 溶液橙色加深 |
ⅱ | 1mL1 mol·L-1 K2CrO | 溶液橙色加深 | 溶液颜色变浅 |
ⅲ | 5~15滴浓硫酸 | 溶液橙色加深 | 溶液橙色加深 |
ⅳ | 5~15滴浓盐酸 | 溶液橙色加深 | 无明显现象 |
ⅴ | 5~15滴6mol·L-1NaOH溶液 | 溶液变黄 | 溶液变黄 |
(1)实验ⅰ没有观察到预期现象的原因是_____,实验ⅱ的原因与其相似。
(2)通过实验ⅲ和ⅴ得出的结论为_____。
(3)实验ⅳ无明显现象,可能的原因是____________。
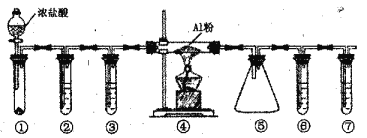
(4)某同学查阅资料发现:K2Cr2O7溶液与浓盐酸可发生氧化还原反应。但实验ⅳ中没有观察到明显现象,小组同学设计了下实验,验证了该反应的发生。
方案:取5 mL浓盐酸,向其中加入15滴0.1mol·L-1 K2Cr2O7溶液,一段时间后,溶液变为绿色(CrCl3水溶液呈绿色),有黄绿色气体生成。写出该变化的化学方程式______。
【答案】ⅴ 变浅 根据平衡移动原理,实验ⅰ中,增大反应物K2Cr2O7浓度,平衡正向移动,使反应物浓度有所减少,但仍高于变化前,所以溶液橙色加深 增大(减少)生成物浓度,平衡逆向(正向)移动 浓盐酸中氢离子浓度远小于浓硫酸中氢离子浓度 14HCl + K2CrO7 ==3Cl2↑+ 2CrCl3 + 2KCl+7H2O
【解析】
K2Cr2O7溶液中存在平衡:![]() +H2O
+H2O![]() 2
2![]() +2H+,增大反应物浓度,平衡正向移动,增大生成物浓度,平衡逆向移动,但平衡移动后溶液的颜色如何变化,不是取决于平衡移动的方向,而是取决于平衡移动前后,有色离子浓度的变化。另外,如果加入的物质对平衡的影响是多方面的,则应综合考虑各种因素对平衡或离子浓度产生的影响。如K2CrO7 溶液中加入浓盐酸,一方面,浓盐酸中的H+对平衡体系(
+2H+,增大反应物浓度,平衡正向移动,增大生成物浓度,平衡逆向移动,但平衡移动后溶液的颜色如何变化,不是取决于平衡移动的方向,而是取决于平衡移动前后,有色离子浓度的变化。另外,如果加入的物质对平衡的影响是多方面的,则应综合考虑各种因素对平衡或离子浓度产生的影响。如K2CrO7 溶液中加入浓盐酸,一方面,浓盐酸中的H+对平衡体系(![]() +H2O
+H2O![]() 2
2![]() +2H+)会产生影响,另一方面,K2CrO7 会被Cl-还原,对c(
+2H+)会产生影响,另一方面,K2CrO7 会被Cl-还原,对c(![]() )也会产生影响。
)也会产生影响。
Ⅰ.(1)ⅰ~ⅴ中,ⅰ为增大反应物浓度,ⅱ~ⅳ为增大生成物浓度,只有ⅴ符合题意,所以依据减少生成物浓度可导致平衡移动的原理设计的是ⅴ。答案为:ⅴ;
(2)加入该Ba(NO3)2溶液后,溶液中的![]() 与Ba2+反应生成BaCrO4黄色沉淀,减少溶液中的c(
与Ba2+反应生成BaCrO4黄色沉淀,减少溶液中的c(![]() ),从而减少溶液中的c(
),从而减少溶液中的c(![]() ),溶液颜色将变浅。答案为:变浅;
),溶液颜色将变浅。答案为:变浅;
Ⅱ.(1)实验ⅰ,虽然平衡右移,但由于增大了c(![]() ),最终溶液中的c(
),最终溶液中的c(![]() )未减反增,从而得出没有观察到预期现象的原因是根据平衡移动原理,实验ⅰ中,增大反应物K2Cr2O7浓度,平衡正向移动,使反应物浓度有所减少,但仍高于变化前,所以溶液橙色加深。答案为:根据平衡移动原理,实验ⅰ中,增大反应物K2Cr2O7浓度,平衡正向移动,使反应物浓度有所减少,但仍高于变化前,所以溶液橙色加深;
)未减反增,从而得出没有观察到预期现象的原因是根据平衡移动原理,实验ⅰ中,增大反应物K2Cr2O7浓度,平衡正向移动,使反应物浓度有所减少,但仍高于变化前,所以溶液橙色加深。答案为:根据平衡移动原理,实验ⅰ中,增大反应物K2Cr2O7浓度,平衡正向移动,使反应物浓度有所减少,但仍高于变化前,所以溶液橙色加深;
(2)实验ⅲ,增大生成物中H+浓度,平衡逆向移动;实验ⅴ,加入的OH-与H+反应生成H2O,减少生成物中H+浓度,平衡正向移动。所以,通过实验ⅲ和ⅴ得出的结论为增大(减少)生成物浓度,平衡逆向(正向)移动。答案为:增大(减少)生成物浓度,平衡逆向(正向)移动;
(3)实验ⅳ无明显现象,表明浓盐酸的加入,对平衡体系中c(![]() )的影响不大,可能的原因是浓盐酸中氢离子浓度远小于浓硫酸中氢离子浓度。答案为:浓盐酸中氢离子浓度远小于浓硫酸中氢离子浓度;
)的影响不大,可能的原因是浓盐酸中氢离子浓度远小于浓硫酸中氢离子浓度。答案为:浓盐酸中氢离子浓度远小于浓硫酸中氢离子浓度;
(4)取5 mL浓盐酸,向其中加入15滴0.1mol·L-1 K2Cr2O7溶液,一段时间后,溶液变为绿色,则生成CrCl3,同时有黄绿色气体生成,表明生成了Cl2。该变化的化学方程式为14HCl + K2CrO7 ==3Cl2↑+ 2CrCl3 + 2KCl+7H2O。答案为:14HCl + K2CrO7 ==3Cl2↑+ 2CrCl3 + 2KCl+7H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案【题目】化学反应伴随能量变化,获取反应能量变化有多条途径。
(1)下列反应中,属于吸热反应的是______(填字母)。
A.Na2O与水反应 B.甲烷的燃烧反应C.CaCO3受热分解 D.锌与盐酸反应
(2)获取能量变化的途径① 通过化学键的键能计算。已知:
化学键种类 | H—H | O=O | O—H |
键能(kJ/mol) | 436 | 498 | 463.4 |
计算可得:2H2(g)+ O2(g) =2H2O(g) H=____________kJ·mol-1
②通过盖斯定律可计算。已知在25℃、101kPa时:
Ⅰ.2Na(s)+![]() O2(g) =Na2O(s)△H=-414kJ·mol-1
O2(g) =Na2O(s)△H=-414kJ·mol-1
Ⅱ.2Na(s)+O2(g) =Na2O2(s)△H=-511kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式__________。
③ 利用实验装置测量。测量盐酸与NaOH溶液反应的热量变化的过程中,若取50 mL 0.50 mol·L-1的盐酸,则还需加入________(填序号)。
A.50 mL 0.50 mol·L-1NaOH溶液B.50 mL 0.55 mol·L-1NaOH溶液 C.1.0 g NaOH固体