题目内容
6.现在含MgCl2、AlCl3均为n mol的混合溶液,向其中滴NaOH溶液至过量.加入NaOH溶液的物质的量与生成沉淀的物质的量的关系正确的是(离子形成沉淀或沉淀的溶解与溶液pH的关系如下表)| 离子 | Mg2+ | Al3+ | 物质 | Al(OH)3 |
| 开始沉淀时的pH | 8.93 | 3.56 | 开始溶解时的pH | 8.04 |
| 完全沉淀时的pH | 10.92 | 4.89 | 完全溶解时的pH | 12.04 |
| A. | 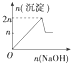 | B. |  | C. |  | D. |  |
分析 根据开始沉淀时的pH可知,当Al3+完全沉淀时,Mg2+还没有开始沉淀;而当Mg2+开始沉淀时,已经有部分氢氧化铝开始溶解;而当Mg2+完全沉淀时,氢氧化铝还没有完全被溶解,据此对各选项进行判断.
解答 解:当Al3+完全沉淀时,溶液的pH=8.04,而镁离子开始沉淀的pH=8.93,则Al3+完全沉淀时Mg2+还没有开始沉淀;
即:当Mg2+开始沉淀时,已经有部分氢氧化铝开始溶解;镁离子完全沉淀的pH=10.92,、氢氧化铝完全溶解的pH=12.04,则当Mg2+完全沉淀时,氢氧化铝还没有完全被溶解,
所以正确的图象应该是C;
故选C.
点评 本题考查MgCl2、AlCl3与氢氧化钠溶液反应生成沉淀时图象的判断,题目难度中等,该题的关键是合理分析镁离子、铝离子恰好沉淀时的pH值,试题侧重考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.P和O2放在两容器中,控制不同条件,分别发生:4P+3O2=2P2O3(容器1),4P+5O2=P2O5(容器2),若在两容器中分别放1mol P和1molO2,充分反应后得到P2O3和P2O5的物质的量之比是( )
| A. | 1:1 | B. | 5:4 | C. | 4:3 | D. | 5:3 |
14.用沉淀法测定NaHCO3和K2CO3混合物的组成.实验过程是每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的Ba(OH)2溶液,每次实验均充分反应.实验记录见下表:
回答下列问题:
(1)写出少量NaHCO3和过量Ba(OH)2溶液反应的离子方程式Ba2++HCO3-+OH-═BaCO3↓+H2O.
(2)第2次实验中产生沉淀的质量是2.758g.
(3)样品中NaHCO3和K2CO3的物质的量之比是2:5.
(4)原Ba(OH)2溶液的浓度为0.056mol•L-1.
(5)室温下取第3组实验所得溶液的1/10,加水配成500mL溶液,则稀释以后溶液的pH值为12.
| 实验次数 | 称取样品的质量/g | 所加Ba(OH)2溶液的体积/mL | 测得生成沉淀的质量/g |
| 1 | 0.858 | 500 | 1.379 |
| 2 | 1.716 | 500 | |
| 3 | 2.574 | 500 | 4.137 |
| 4 | 3.432 | 500 | 5.516 |
| 5 | 4.290 | 500 | 5.516 |
| 6 | 5.148 | 500 | 5.516 |
(1)写出少量NaHCO3和过量Ba(OH)2溶液反应的离子方程式Ba2++HCO3-+OH-═BaCO3↓+H2O.
(2)第2次实验中产生沉淀的质量是2.758g.
(3)样品中NaHCO3和K2CO3的物质的量之比是2:5.
(4)原Ba(OH)2溶液的浓度为0.056mol•L-1.
(5)室温下取第3组实验所得溶液的1/10,加水配成500mL溶液,则稀释以后溶液的pH值为12.
15.对下列有关物质同分异构体(不考虑立体异构)数目的分析中正确的是( )
| 选项 | 分子式 | 限定条件 | 数目 |
| A | C2H4O2 | 能与Na2CO3溶液反应 | 2 |
| B | C4H8Cl2 | 分子中有一个甲基 | 3 |
| C | C4H10O | 不能与钠反应 | 2 |
| D | C8H10 | 含有苯环 | 3 |
| A. | A | B. | B | C. | C | D. | D |
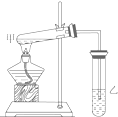 如图是某学生设计的制取乙酸乙酯的实验装置图,实验中采取了以下主要实验操作:
如图是某学生设计的制取乙酸乙酯的实验装置图,实验中采取了以下主要实验操作: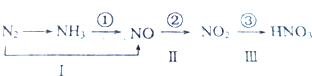
 .
.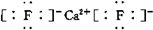 ;若XY2为共价化合物时,其结构式为:S=C=S.
;若XY2为共价化合物时,其结构式为:S=C=S.