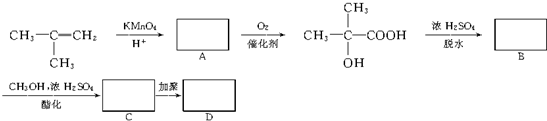
题目内容
16.P和O2放在两容器中,控制不同条件,分别发生:4P+3O2=2P2O3(容器1),4P+5O2=P2O5(容器2),若在两容器中分别放1mol P和1molO2,充分反应后得到P2O3和P2O5的物质的量之比是( )| A. | 1:1 | B. | 5:4 | C. | 4:3 | D. | 5:3 |
分析 如果按4P+3O2=2P2O3(容器1),O2过量,n(P2O3)=$\frac{1}{2}$n(P)$\frac{1}{2}$ mol;如果按4P+5O2=P2O5(容器2),P过量,n(P2O5)=$\frac{2}{5}$n(O2)=$\frac{2}{5}$mol,然后求两者的物质的量之比.
解答 解:按4P+3O2=2P2O3(容器1),O2过量,n(P2O3)=$\frac{1}{2}$n(P)$\frac{1}{2}$ mol;按4P+5O2=P2O5(容器2),P过量,n(P2O5)=$\frac{2}{5}$n(O2)=$\frac{2}{5}$mol,所以充分反应后得到P2O3和P2O5的物质的量之比是$\frac{1}{2}$:$\frac{2}{5}$=5:4,故选B.
点评 本题考查有磷与氧气按不同量之比得到和产物物不同的过量问题的判断,学生只要能按照两种反应的原理进行过量计算,就可以解答了.

练习册系列答案
相关题目
7.部分弱酸的电离平衡常数如下表:
下列选项正确的是( )
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | K=1.77×10-4 | K=4.9×10-10 | K1=4.3×10-7,K2=5.6×10-11 |
| A. | 在NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-) | |
| B. | 向NaCN溶液中通入少量CO2的离子方程式:2CN-+H2O+CO2=2HCN+CO32- | |
| C. | 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者 | |
| D. | 等物质的量浓度的各溶液pH关系为:pH(NaHCO3)>pH(NaCN)>pH(HCOONa) |
4.下列有关说法中正确的是( )
| A. | 0.1 mol/L Na2SO3溶液中c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3) | |
| B. | 0.1 mol•L-1 NaHCO3溶液中;c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | 对滴有酚酞的CH3COONa溶液进行加热,溶液颜色会加深 | |
| D. | 在pH=5.6的CH3COOH与CH3COONa的混合溶液中:c(Na+)>c(CH3COO-) |
11.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,33.6 L 氟化氢中含有氟原子的数目为1.5NA | |
| B. | pH均为5的NH4Cl和NaHSO4溶液中水电离出的氢离子数目均为10-5NA | |
| C. | 在1L 0.1 mol•L-1CuSO4溶液中,阴离子总数大于0.1 NA | |
| D. | 某密闭容器盛有0.1molN2和0.3molIH2,在一定条件下充分反应,转移电子的数目为 NA |
1.下列是A、B、C、D、E五种短周期元素的某些性质:
(1)A原子的核外电子排布的轨道表示式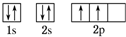 C原子的价电子排布式3s23p5
C原子的价电子排布式3s23p5
(2)A、B、C、G对应的最高价氧化物的水化物酸性最强的是HClO4(写化学式).
(3)相同条件下,AD2与BD2分子在水中的溶解度较大的是SO2(写化学式),理由是CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”,SO2在H2O中的溶解度较大.
(4)A、B、D形成的氢化物沸点:H2O更高,热稳定性H2O更强.(写化学式)
(5)根据等电子原理(化学通式相同且价电子总数相等的分子或离子,结构相似),写出AD分子的结构式C≡O.
(6)已知AG-与G2结构相似,推算HAG分子中σ键与π键数目之比为1:1.
| A | B | C | D | E | G | |
| 最低化合价 | -4 | -2 | -1 | -2 | -1 | -3 |
| 电负性 | 2.55 | 2.58 | 3.16 | 3.44 | 3.98 | 3.0 |
 C原子的价电子排布式3s23p5
C原子的价电子排布式3s23p5(2)A、B、C、G对应的最高价氧化物的水化物酸性最强的是HClO4(写化学式).
(3)相同条件下,AD2与BD2分子在水中的溶解度较大的是SO2(写化学式),理由是CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”,SO2在H2O中的溶解度较大.
(4)A、B、D形成的氢化物沸点:H2O更高,热稳定性H2O更强.(写化学式)
(5)根据等电子原理(化学通式相同且价电子总数相等的分子或离子,结构相似),写出AD分子的结构式C≡O.
(6)已知AG-与G2结构相似,推算HAG分子中σ键与π键数目之比为1:1.
8.己知某温度下,Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1.12×10-12,下列叙述正确的是( )
| A. | 向氯化银的浊液中加入氯化钠溶液,氯化银的溶解度减小 | |
| B. | 向2.0×10-1mol/L的K2CrO4溶液中加入等体积的2.0×10-1mol/LAgNO3溶液,则有Ag2CrO4沉淀生成 | |
| C. | 将一定量的AgCl和Ag2CrO4固体棍合物溶于蒸馏水中,充分溶解后,静置,上层清液中Cl-的物质的量浓度最大 | |
| D. | 将0.001 mol/L的AgNO3溶液滴入0.001mol/L的KCl和0.001 mol/L的K2CrO4溶液,则先产生AgCl沉淀 |
5.反应2A(g)+5B(g)?4C(g)+6D(g)在1L密闭容器中进行,0.5min后,A减少了0.90mol,则此反应的速率可表示为( )
| A. | v(A)=3.6mol/(L•s) | B. | v(B)=0.075mol/(L•s) | C. | v(C)=0.030mol/(L•s) | D. | v(D)=0.060mol/(L•s) |
6.现在含MgCl2、AlCl3均为n mol的混合溶液,向其中滴NaOH溶液至过量.加入NaOH溶液的物质的量与生成沉淀的物质的量的关系正确的是(离子形成沉淀或沉淀的溶解与溶液pH的关系如下表)
( )
| 离子 | Mg2+ | Al3+ | 物质 | Al(OH)3 |
| 开始沉淀时的pH | 8.93 | 3.56 | 开始溶解时的pH | 8.04 |
| 完全沉淀时的pH | 10.92 | 4.89 | 完全溶解时的pH | 12.04 |
| A. | 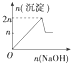 | B. |  | C. |  | D. |  |