题目内容
14.用沉淀法测定NaHCO3和K2CO3混合物的组成.实验过程是每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的Ba(OH)2溶液,每次实验均充分反应.实验记录见下表:| 实验次数 | 称取样品的质量/g | 所加Ba(OH)2溶液的体积/mL | 测得生成沉淀的质量/g |
| 1 | 0.858 | 500 | 1.379 |
| 2 | 1.716 | 500 | |
| 3 | 2.574 | 500 | 4.137 |
| 4 | 3.432 | 500 | 5.516 |
| 5 | 4.290 | 500 | 5.516 |
| 6 | 5.148 | 500 | 5.516 |
(1)写出少量NaHCO3和过量Ba(OH)2溶液反应的离子方程式Ba2++HCO3-+OH-═BaCO3↓+H2O.
(2)第2次实验中产生沉淀的质量是2.758g.
(3)样品中NaHCO3和K2CO3的物质的量之比是2:5.
(4)原Ba(OH)2溶液的浓度为0.056mol•L-1.
(5)室温下取第3组实验所得溶液的1/10,加水配成500mL溶液,则稀释以后溶液的pH值为12.
分析 (1)少量NaHCO3和过量Ba(OH)2溶液反应,量少的全部反应,离子方程式中NaHCO3的系数为1书写;
(2)第3次、第4次生成沉淀碳酸钡的质量都为5.516g,说明样品质量为3.342g时,氢氧化钡已经完全反应,第1次、第3次样品的质量分别为0.858g、2.574g,第1次、第3次生成沉淀碳酸钡质量分别为1.379g、4.137g,样品的质量之比等于生成的沉淀质量之比为1:2,说明第3次恰好完全反应,根据第1次与第2次样品之比计算第2次生成沉淀的质量;
(3)第3次实验中样品完全反应,令碳酸氢钠与碳酸钾的物质的量分别为xmol、ymol,根据碳元素守恒可知沉淀碳酸钡的物质的量为(x+y)mol,根据样品质量与碳酸钡沉淀质量列方程计算;
(4)实验中每次滴加相同浓度的Ba(OH)2溶液0.5L,第4次、第5次生成沉淀碳酸钡质量都为5.516g,说明样品质量为3.342g时,氢氧化钡已经完全反应,碳酸钡的物质的量为$\frac{5.516g}{197g/mol}$=0.028mol,根据钡离子守恒可知,氢氧化钡的物质的量为0.028mol,然后求出Ba(OH)2溶液物质的量浓度;
(5)第3组实验反应后溶液为氢氧化钡、氢氧化钠、氢氧化钾的混合溶液,由钡离子守恒计算溶液中钡离子物质的量,由钠离子守恒可知,溶液中n(NaOH)=n(NaHCO3),由钾离子守恒可知,溶液中n(KOH)=2n(K2CO3),根据溶液中氢氧化钡、氢氧化钠、氢氧化钾的物质的量计算氢氧根的浓度,在计算稀释后氢氧根的浓度,利用pH值定义计算.
解答 解:(1)少量NaHCO3和过量Ba(OH)2溶液反应,量少的全部反应,离子方程式为Ba2++HCO3-+OH-═BaCO3↓+H2O,故答案为:Ba2++HCO3-+OH-═BaCO3↓+H2O;
(2)第3次、第4次生成沉淀碳酸钡的质量都为5.516g,说明样品质量为3.342g时,氢氧化钡已经完全反应,第1次、第3次样品的质量分别为0.858g、2.574g,第1次、第3次生成沉淀碳酸钡质量分别为1.379g、4.137g,样品的质量之比等于生成的沉淀质量之比为1:2,说明第3次恰好完全反应,第2次实验中样品完全反应,令产生沉淀质量为mg,则1.716g:2.574g=mg:4.137g,解得m=2.758,故答案为:2.758;
(3)第3次实验中样品完全反应,令碳酸氢钠与碳酸钾的物质的量分别为xmol、ymol,则:
84x+138y=2.574
197x+197y=4.137,
解得x=0.006,y=0.015.
NaHCO3和K2CO3的物质的量之比为2:5,
故答案为:2:5;
(4)实验中每次滴加相同浓度的Ba(OH)2溶液0.5L,第4次、第5次生成沉淀碳酸钡质量都为5.516g,说明样品质量为3.342g时,氢氧化钡已经完全反应,碳酸钡的物质的量为$\frac{5.516g}{197g/mol}$=0.028mol,根据钡离子守恒可知,氢氧化钡的物质的量为0.028mol,所以Ba(OH)2溶液中溶质的物质的量浓度是$\frac{0.028mol}{0.5L}$=0.056mol/L,故答案为:0.056;
(5)实验中每次滴加相同浓度的Ba(OH)2溶液500mL,第3次、第4次生成沉淀碳酸钡质量都为5.516g,说明样品质量为3.342g时,氢氧化钡已经完全反应,碳酸钡的物质的量为$\frac{5.516g}{197g/mol}$=0.028mol,根据钡离子守恒可知氢氧化钡的物质的量为0.028mol,
第3组实验反应后溶液为氢氧化钡、氢氧化钠、氢氧化钾的混合溶液.4.137g碳酸钡的物质的量为$\frac{4.137g}{197g/mol}$=0.021mol,由钡离子守恒可知,溶液中n[Ba(OH)2]=0.028mol-0.021mol=0.007mol;由钠离子守恒可知,溶液中n(NaOH)=n(NaHCO3)=0.006mol;由钾离子守恒可知,溶液中n(KOH)=2n(K2CO3)=2×0.015mol=0.03mol;所以溶液中n(OH-)=2n[Ba(OH)2]+n(NaOH)+n(KOH)=0.007mol×2+0.006mol+0.03mol=0.05mol,取所得溶液体积的$\frac{1}{10}$,含有的氢氧根的物质的量为0.005mol,加水配成500mL溶液,氢氧根的浓度为$\frac{0.005mol}{0.5L}$=0.01mol/L,所以c(H+)=10-12mol/L,所以溶液的pH=-lg10-12=12,
故答案为:12.
点评 本题考查混合物的计算、实验数据分析处理、pH值计算等,综合性较大,难度较大,旨在考查学生的综合能力,是一道不错的能力考查题.

| A. | 0.1 mol/L Na2SO3溶液中c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3) | |
| B. | 0.1 mol•L-1 NaHCO3溶液中;c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | 对滴有酚酞的CH3COONa溶液进行加热,溶液颜色会加深 | |
| D. | 在pH=5.6的CH3COOH与CH3COONa的混合溶液中:c(Na+)>c(CH3COO-) |
| A. | v(A)=3.6mol/(L•s) | B. | v(B)=0.075mol/(L•s) | C. | v(C)=0.030mol/(L•s) | D. | v(D)=0.060mol/(L•s) |
| A. | X>2 | B. | X=2 | C. | 2>X>1 | D. | X=1 |
| A. | 2 mol/L NaOH的溶液 | B. | 2 mol/L Na2SO4的溶液 | ||
| C. | 2 mol/L MgSO4的溶液 | D. | FeCl3溶液 |
| 离子 | Mg2+ | Al3+ | 物质 | Al(OH)3 |
| 开始沉淀时的pH | 8.93 | 3.56 | 开始溶解时的pH | 8.04 |
| 完全沉淀时的pH | 10.92 | 4.89 | 完全溶解时的pH | 12.04 |
| A. |  | B. |  | C. |  | D. |  |
①石墨不如金刚石稳定
②金刚石不如石墨稳定
③等质量的石墨和金刚石完全燃烧,金刚石放出的能量多
④等质量的石墨和金刚石完全燃烧,石墨放出的能量多.
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
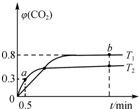 利用I2O5可消除CO污染,反应为5CO(g)+I2O5(s)?5CO2(g)+I2(s);△H.不同温度(T1、T2)下,向装有足量I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示.下列说法正确的是( )
利用I2O5可消除CO污染,反应为5CO(g)+I2O5(s)?5CO2(g)+I2(s);△H.不同温度(T1、T2)下,向装有足量I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示.下列说法正确的是( )| A. | T1<T2,△H>0 | |
| B. | T1温度下,该反应的平衡常数为1 024 | |
| C. | T2温度下,0~0.5 min内,CO的平均反应速率为0.3 mol•L-1•min-1 | |
| D. | T1温度下,若向装有足量I2固体的2 L恒容密闭容器中通入10 mol CO2,达到平衡时,φ(CO2)=0.8 |