题目内容
1.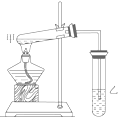 如图是某学生设计的制取乙酸乙酯的实验装置图,实验中采取了以下主要实验操作:
如图是某学生设计的制取乙酸乙酯的实验装置图,实验中采取了以下主要实验操作:①在甲试管中依次加入浓硫酸、乙醇、乙酸 ②小心均匀加热3-5min
(1)该学生设计的实验装置及操作错误的是AC
A.乙试管的导管插入液面下
B.导气管太短,未起冷凝回流作用
C.先加浓硫酸再加乙醇、乙酸
D.甲试管中导管太短
(2)需小心均匀加热的原因是防止暴沸.
(3)乙试管中所盛液体是饱和Na2CO3溶液,其作用是除去乙酸,吸收乙醇,且乙酸乙酯的溶解度在Na2CO3溶液中较小,便于收集乙酸乙酯.
(4)从反应后的混合液中提取乙酸乙酯,宜采用的简便方法是C.
A.蒸馏 B.过滤 C.分液 D.结晶.
分析 (1)A.导管若插入溶液中,可能因甲试管中气压降低,而使乙试管中溶液倒吸到甲试管中;
B.由于乙醇、乙酸乙酯的沸点比较低,应用长导管,除导气同时起冷凝回流作用;
C.乙醇、乙酸易挥发,应将浓硫酸注入乙醇中,冷却后再加入乙酸,减少乙酸挥发;
D.甲试管中导管不能太长,否则影响生成的乙酸乙酯的导出;
(2)受热不均,易引起暴沸;
(3)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,主要是利用了乙酸乙酯难溶于饱和碳酸钠,乙醇与水混溶,乙酸能被碳酸钠吸收,易于除去杂质,
(4)分离互不相溶的用途采取分液的方法.
解答 解:(1)A.导管若插入溶液中,乙酸乙酯冷凝及乙酸、乙醇溶解可能导致甲试管中气压降低,而使乙试管中溶液倒吸到甲试管中,使实验失败,故A错误;
B.由于乙醇、乙酸乙酯的沸点比较低,为减少反应物及生成物挥发造成的损失,导气管应该长一些,使乙酸乙酯能冷凝为液体流到乙试管中,故B正确;
C.应先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,最后加入冰醋酸,故C错误;
D.甲试管中导管不能太长,否则影响生成的乙酸乙酯的导出,故D正确;
故答案为:AC;
(2)由于受热不均,易引起暴沸,需要小心均匀加热,防止暴沸,
故答案为:防止暴沸;
(3)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,主要是利用了乙酸乙酯难溶于饱和碳酸钠,乙醇与水混溶,乙酸能被碳酸钠吸收,易于除去杂质,
故答案为:饱和Na2CO3溶液;除去乙酸,吸收乙醇,且乙酸乙酯的溶解度在Na2CO3溶液中较小,便于收集乙酸乙酯;
(4)乙酸乙酯与水不混溶,且是液体混合溶液,故可采用分液的方法进行分离,故C正确,
故答案为:C.
点评 本题主要考查乙酸乙酯的制备,注意对装置、碳酸钠溶液作用的理解,掌握混合溶液的配制,难度不大.

练习册系列答案
相关题目
11.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,33.6 L 氟化氢中含有氟原子的数目为1.5NA | |
| B. | pH均为5的NH4Cl和NaHSO4溶液中水电离出的氢离子数目均为10-5NA | |
| C. | 在1L 0.1 mol•L-1CuSO4溶液中,阴离子总数大于0.1 NA | |
| D. | 某密闭容器盛有0.1molN2和0.3molIH2,在一定条件下充分反应,转移电子的数目为 NA |
12.在锌铜原电池中,当导线中有1mole-通过时,从理论上分析,两极的变化是( )
①锌片溶解了32.5g ②锌片增重了32.5g
③铜片上析出1g氢气 ④铜片上析出1mol氢气.
①锌片溶解了32.5g ②锌片增重了32.5g
③铜片上析出1g氢气 ④铜片上析出1mol氢气.
| A. | ①和③ | B. | ①和④ | C. | ②和③ | D. | ②和④ |
9.将某溶液逐滴加入Al(OH)3溶胶内,开始产生沉淀,继续滴加时沉淀又溶解,该溶液是( )
| A. | 2 mol/L NaOH的溶液 | B. | 2 mol/L Na2SO4的溶液 | ||
| C. | 2 mol/L MgSO4的溶液 | D. | FeCl3溶液 |
16.下列物质不能用于萃取溴水中溴的是( )
| A. | 直馏汽油 | B. | 裂化汽油 | C. | 酒精 | D. | 己烷 |
6.现在含MgCl2、AlCl3均为n mol的混合溶液,向其中滴NaOH溶液至过量.加入NaOH溶液的物质的量与生成沉淀的物质的量的关系正确的是(离子形成沉淀或沉淀的溶解与溶液pH的关系如下表)
( )
| 离子 | Mg2+ | Al3+ | 物质 | Al(OH)3 |
| 开始沉淀时的pH | 8.93 | 3.56 | 开始溶解时的pH | 8.04 |
| 完全沉淀时的pH | 10.92 | 4.89 | 完全溶解时的pH | 12.04 |
| A. | 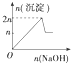 | B. | 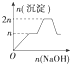 | C. |  | D. | 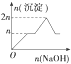 |
10.现有8中元素的性质、数据如下表所列,它们属于第二或第三周期
回答下列问题:(用元素符号或化学式填写)
(1)②的元素符号是Be;③的元素名称是硼;①在元素周期表中的位置是(周期,族)第二周期ⅥA族;⑧的离子结构示意图:
(2)比较⑤和⑥的最高价氧化物对应水化物的酸性大小:HClO4>HNO3;
(3)比较⑥和⑦的氢化物的稳定性:NH3>SiH4;⑥的氢化物电子式为 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”);
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”);
(4)写出⑥的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:NH3+HNO3=NH4HNO3
(5)写出⑧的最高价氧化物对应水化物跟短周期中碱性最强的氢氧化物反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(6)④的氢化物与⑤的单质(体积比为1:2)在光照条件下反应,生成的有机产物有4种,其中常温下是气体的是CH3Cl,含有4个相同极性键的是CCl4.
| 元素性质 编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 0.89 | 0.82 | 0.77 | 0.99 | 0.75 | 1.17 | 1.43 |
| 最高或最低化合价 | +2 | +3 | +4 | +7 | +5 | +4 | +3 | |
| -2 | -4 | -1 | -3 | -4 |
(1)②的元素符号是Be;③的元素名称是硼;①在元素周期表中的位置是(周期,族)第二周期ⅥA族;⑧的离子结构示意图:

(2)比较⑤和⑥的最高价氧化物对应水化物的酸性大小:HClO4>HNO3;
(3)比较⑥和⑦的氢化物的稳定性:NH3>SiH4;⑥的氢化物电子式为
 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”);
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”);(4)写出⑥的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:NH3+HNO3=NH4HNO3
(5)写出⑧的最高价氧化物对应水化物跟短周期中碱性最强的氢氧化物反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(6)④的氢化物与⑤的单质(体积比为1:2)在光照条件下反应,生成的有机产物有4种,其中常温下是气体的是CH3Cl,含有4个相同极性键的是CCl4.
15.下列有关化学用语表示正确的是( )
| A. | 中子数为20的氯原子:${\;}_{17}^{20}Cl$ | B. | 四氯化碳的电子式: | ||
| C. | 铝原子的结构示意图: | D. | 二氧化碳的结构式:O-C-O |