题目内容
11.工业上硝酸的制备和自然界中硝酸的生成既有相同的地方,又有区别.线路①、②、③是工业生产硝酸的主要途径,线路Ⅰ、Ⅱ、Ⅲ是雷电高能固氮过程中硝酸的生成途径.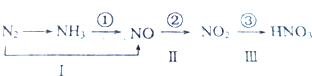
①完成下列反应的化学方程式:
写出①的化学方程式:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,写出Ⅲ的化学方程式:3NO2+H2O=2HNO3+NO.
②下列环境问题与NO2的排放有关的是BE(填字母序号)
A.赤潮 B.光化学烟雾 C.臭氧空洞 D.温室效应 E.酸雨
③把盛有NO2和N2的混合气体的试管倒立在盛水的水槽中,最终液面上升到距试管底部$\frac{2}{3}$处,则原混合气体中NO2和N2的
体积比为1:1.
分析 ①反应①是氨气的催化氧化反应生成一氧化氮和水,反应Ⅲ是二氧化氮和水反应生成硝酸和一氧化氮;
②A.赤潮的形成是因为人类生产生活产生的大量污水排放使得海水中氮、磷等营养物质的含量突然增加,造成海水富营养化;
B.行驶的汽车大量排放含氮氧化物、一氧化碳、碳氢化合物等废气,在强烈的日光作用下,这些排放物发生光化反应,生成二次污染物.这是一种浅蓝色、有刺激性的烟雾--光化学烟雾;
C.造成臭氧空洞的物质的氟氯代烃;
D.造成温室效应的气体是二氧化碳;
E、二氧化硫、氮氧化物的排放会形成酸雨;
③N2和NO2混合气体的试管倒立在水槽中,发生3NO2+H2O═2HNO3+NO,利用体积差来计算混合气体中NO2的体积,以此来解答.
解答 解:①反应①是氨气的催化氧化反应生成一氧化氮和水,反应的化学方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;反应Ⅲ是二氧化氮和水反应生成硝酸和一氧化氮,反应的化学方程式为:3NO2+H2O=2HNO3+NO;
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,3NO2+H2O=2HNO3+NO;
②A.造成赤潮的物质是N、P化合物,故A错误;
B.光化学烟雾,是城市大气中的碳氢化合物(HC)和氮氧化合物(NOx)在阳光紫外线的作用下发生的一系列链式大气化学反应生成以臭氧(O3)为代表的刺激性二次污染物,与NO2有关,故B正确;
C.引起臭氧空洞的主要原因是一种叫“氟利昂”的物质破坏了平流层大气中的臭氧,故C错误;
D.造成温室效应的气体是二氧化碳,而不是二氧化氮,故D错误;
E、酸雨是因为二氧化硫、氮氧化物的排放,以及一些工业气体的排放,与二氧化氮的排放有关,故E正确;
故答案为:BE;
③设原混合气体中含有xmolN2,ymolNO2,最终液面上升到距试管底部$\frac{2}{3}$处,说明气体体积减小$\frac{1}{3}$,则
盛有N2和NO2 的混合气体的试管倒立于水中发生3NO2+H2O=2HNO3+NO,则
3NO2+H2O=2HNO3+NO
3 1
y $\frac{y}{3}$
则(x+$\frac{y}{3}$):(x+y)=2:3,
解得x:y=1:1,
故答案为:1:1.
点评 本题考查了环境污染,氮氧化物性质分析,和混合气体溶于水的计算应用,明确物质的性质是解本题关键,注意保护环境,题目难度中等.

| A | B | C | D | E | G | |
| 最低化合价 | -4 | -2 | -1 | -2 | -1 | -3 |
| 电负性 | 2.55 | 2.58 | 3.16 | 3.44 | 3.98 | 3.0 |
 C原子的价电子排布式3s23p5
C原子的价电子排布式3s23p5(2)A、B、C、G对应的最高价氧化物的水化物酸性最强的是HClO4(写化学式).
(3)相同条件下,AD2与BD2分子在水中的溶解度较大的是SO2(写化学式),理由是CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”,SO2在H2O中的溶解度较大.
(4)A、B、D形成的氢化物沸点:H2O更高,热稳定性H2O更强.(写化学式)
(5)根据等电子原理(化学通式相同且价电子总数相等的分子或离子,结构相似),写出AD分子的结构式C≡O.
(6)已知AG-与G2结构相似,推算HAG分子中σ键与π键数目之比为1:1.
| A. | X>2 | B. | X=2 | C. | 2>X>1 | D. | X=1 |
| 离子 | Mg2+ | Al3+ | 物质 | Al(OH)3 |
| 开始沉淀时的pH | 8.93 | 3.56 | 开始溶解时的pH | 8.04 |
| 完全沉淀时的pH | 10.92 | 4.89 | 完全溶解时的pH | 12.04 |
| A. |  | B. |  | C. |  | D. |  |
①石墨不如金刚石稳定
②金刚石不如石墨稳定
③等质量的石墨和金刚石完全燃烧,金刚石放出的能量多
④等质量的石墨和金刚石完全燃烧,石墨放出的能量多.
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
| A. | 浓氨水 | B. | NaOH | C. | Ba(OH)2 | D. | Ca(OH)2 |
